
| 溫度℃ 溶解度 溶質 g/100g水 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
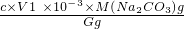 ×100%,故答案為:
×100%,故答案為: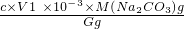 ×100%;
×100%;

 百年學典課時學練測系列答案
百年學典課時學練測系列答案 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案科目:高中化學 來源: 題型:閱讀理解
| 溫度℃ 溶解度 溶質 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
查看答案和解析>>
科目:高中化學 來源: 題型:

(1)碳酸氫銨與飽和食鹽水反應,能析出碳酸氫鈉晶體的原因是________ (填標號)。
A.碳酸氫鈉難溶于水?
B.碳酸氫鈉的溶解度相對較小,所以在溶液中首先結晶析出?
C.碳酸氫鈉受熱易分解?
(2)某探究活動小組根據工業制取碳酸鈉的原理,進行碳酸氫鈉的制備實驗, 同學們按各自設計的方案實驗。?
①一位同學將二氧化碳氣體通入含氨的飽和食鹽水中制備碳酸氫鈉,實驗裝置如下圖所示(圖中夾持、固定用的儀器未畫出)。?
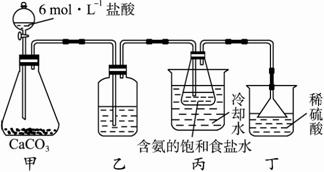
i.乙裝置中的試劑是_______________(填標號)。?
A.燒堿溶液?
B.澄清石灰水?
C.濃氨水?
D.蒸餾水?
ii.丁裝置的作用是_________________________。?
iii.實驗結束后,分離出NaHCO3晶體的操作是_________________(填名稱)。
②另一位同學用下圖中戊裝置(其他裝置未畫出)進行實驗。
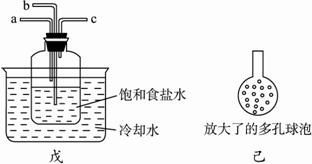
i.實驗時,須先從a管通入_________氣體,再從b管通入____________氣體。?
ii.有同學建議在b管下端連接上圖中己裝置,理由是__________________________。?
(3)請你再寫出一種實驗室制取少量碳酸氫鈉的方法。____________________________。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年上海市四區(楊浦、青浦、寶山、靜安)高三下學期二模化學試卷(解析版) 題型:實驗題
碳酸鈉俗稱純堿,其用途很廣。實驗室中,用碳酸氫銨和飽和食鹽水可制得純堿。各物質在不同溫度下的溶解度見表。
|
溶解度 溶質 g/100g水 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
|
NH4HCO3 |
15.8 |
21.0 |
27.0 |
|
|
|
|
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
14.4 |
16.4 |
|
|
NH4Cl |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
實驗步驟
Ⅰ、化鹽與精制:①粗鹽(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③過濾;④加入鹽酸調pH至7。
Ⅱ、轉化:①將精制后的食鹽溶液溫度控制在30~35℃之間;在不斷攪拌下,加入研細的碳酸氫銨;保溫,攪拌半小時;②靜置, a 、 b ;③得到NaHCO3晶體。
Ⅲ、制純堿:將得的NaHCO3放入蒸發皿中,在酒精燈上灼燒,冷卻到室溫,即得到純堿。
完成下列填空:
(1)“化鹽與精制”可除去的粗鹽中的雜質離子是 。
(2)“轉化”的離子方程式是 。
(3)“轉化”過程中,溫度控制在30~35℃之間的加熱方式是 ;為什么溫度控制在30~35℃之間? 。
(4)a、b處的操作分別是 、 。
(5)實驗室制得的純堿含少量NaCl還可能含少量NaHCO3,為測定純堿的純度,用電子天平準確稱取樣品G克,將其放入錐形瓶中用適量蒸餾水溶解,滴加2滴酚酞,用c mol/L的標準鹽酸滴定至溶液由淺紅色變成無色且半分鐘不變,滴定過程中無氣體產生,所用鹽酸的體積為V1 mL。此時發生的反應為:CO32- + H+ →HCO3-
①樣品中碳酸鈉質量百分含量的表達式是 。
②向錐形瓶溶液中繼續滴加2滴甲基橙,用同濃度的鹽酸繼續滴定至終點,所用鹽酸的體積為V2mL。滴定終點時溶液顏色的變化是 ;根據實驗數據,如何判斷樣品含有NaHCO3 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com