
常溫下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲線如下圖。下列說法正確的是
溶液所得滴定曲線如下圖。下列說法正確的是
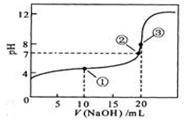
A.點①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.點②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C.點③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:

 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 滴定次數 實驗數據 |
1 | 2 | 3 | 4 |
| V(醋酸溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(終讀數) | 14.98 | 15.20 | 15.12 | 15.95 |

查看答案和解析>>
科目:高中化學 來源: 題型:
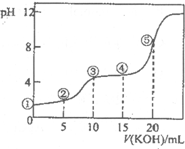 常溫下,用0.10mol?L-1 KOH溶液滴定10.00ml 0.10mol?L-1 H2C2O4(二元弱酸)溶液所得滴定曲線如圖(混合溶液的體積可看成混合前溶液的體積之和).下列說法正確的是( )
常溫下,用0.10mol?L-1 KOH溶液滴定10.00ml 0.10mol?L-1 H2C2O4(二元弱酸)溶液所得滴定曲線如圖(混合溶液的體積可看成混合前溶液的體積之和).下列說法正確的是( )查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com