
(4分)0.3mol的氣態高能燃料乙硼烷(B2H6)在氧氣中燃燒,生成固態三氧化二硼和液態水,放出649.5千焦熱量,其熱化學方程式是 ,
又已知:H2O(液)=H2O(氣);△H =+44kJ/mol,則11.2升(標準狀況下)乙硼烷完全燃燒時生成氣態水時放出的熱量為 。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:閱讀理解
以節能減排為基礎的低碳經濟已成為實現人類可持續發展的重要課題。
(1)控制和治理CO2是解決溫室效應的有效途徑,其中一種途徑是將CO2轉化成有機物實現碳循環。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
則由C2H5OH(1)轉化為C2H4(g)和H2O(1)的熱化學方程式為 。
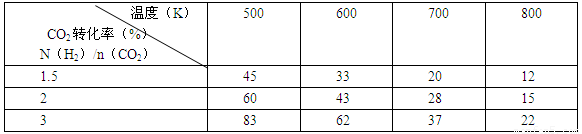
(2)為探究反應6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
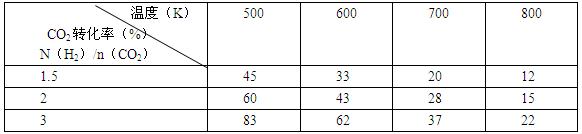
根據表中實驗數據分析:
①該反應的正反應為 (填“吸熱”或“放熱”)反應。
②為提高CO2的平衡轉化率,可采取的措施有 (寫出一條即可)。
(3)一定條件下,將3 mol H2 和1mol CO2氣態混合物充入2L 密閉容器中,發生如下反應:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是 。
CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是 。
A.該反應的平衡常數表達式為![]()
B.CO2的平衡轉化率為40%
C.2min內H2的平均反應速率為0.3mol/(L·min)
D.該反應達到平衡狀態的標志是混合氣體的密度不發生改變
(4)右圖是甲烷燃料電池的工作原理示意圖,電解質溶液為KOH溶液。則負極室通入的氣體是 (填“甲烷”或“氧氣”);正極室電極上發生的電極反應是 ;其電池的總反應為 。比起直接燃燒燃料產生電力,使用燃料電池有許多優點,其中主要有兩點:首先是能量轉化效率高,其次是 。

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
以節能減排為基礎的低碳經濟已成為實現人類可持續發展的重要課題。
(1)控制和治理CO2是解決溫室效應的有效途徑,其中一種途徑是將CO2轉化成有機物實現碳循環。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
則由C2H5OH(1)轉化為C2H4(g)和H2O(1)的熱化學方程式為 。
(2)為探究反應6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
根據表中實驗數據分析:
①該反應的正反應為 (填“吸熱”或“放熱”)反應。
②為提高CO2的平衡轉化率,可采取的措施有 (寫出一條即可)。
(3)一定條件下,將3 mol H2 和1mol CO2氣態混合物充入2L 密閉容器中,發生如下反應:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是 。
CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是 。
A.該反應的平衡常數表達式為![]()
B.CO2的平衡轉化率為40%
C.2min內H2的平均反應速率為0.3mol/(L·min)
D.該反應達到平衡狀態的標志是混合氣體的密度不發生改變
(4)右圖是甲烷燃料電池的工作原理示意圖,電解質溶液為KOH溶液。則負極室通入的氣體是 (填“甲烷”或“氧氣”);正極室電極上發生的電極反應是 ;其電池的總反應為 。比起直接燃燒燃料產生電力,使用燃料電池有許多優點,其中主要有兩點:首先是能量轉化效率高,其次是 。
查看答案和解析>>
科目:高中化學 來源:2011屆河南省普通高中畢業班高考適應性測試試卷(理綜)化學部分 題型:填空題
以節能減排為基礎的低碳經濟已成為實現人類可持續發展的重要課題。
(1)控制和治理CO2是解決溫室效應的有效途徑,其中一種途徑是將CO2轉化成有機物實現碳循環。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
則由C2H5OH(1)轉化為C2H4(g)和H2O(1)的熱化學方程式為 。
(2)為探究反應6H2(g)+2CO2(g)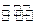 CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗: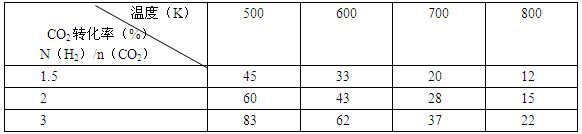
根據表中實驗數據分析:
①該反應的正反應為 (填“吸熱”或“放熱”)反應。
②為提高CO2的平衡轉化率,可采取的措施有 (寫出一條即可)。
(3)一定條件下,將3 mol H2和1mol CO2氣態混合物充入2L密閉容器中,發生如下反應:3H2(g)+CO2(g)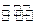 CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是 。
CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是 。
A.該反應的平衡常數表達式為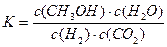 |
| B.CO2的平衡轉化率為40% |
| C.2min內H2的平均反應速率為0.3mol/(L·min) |
| D.該反應達到平衡狀態的標志是混合氣體的密度不發生改變 |
查看答案和解析>>
科目:高中化學 來源:2010-2011學年河南省畢業班高考適應性測試試卷(理綜)化學部分 題型:填空題
以節能減排為基礎的低碳經濟已成為實現人類可持續發展的重要課題。
(1)控制和治理CO2是解決溫室效應的有效途徑,其中一種途徑是將CO2轉化成有機物實現碳循環。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
則由C2H5OH(1)轉化為C2H4(g)和H2O(1)的熱化學方程式為 。
(2)為探究反應6H2(g)+2CO2(g)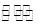 CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
CH3CH2OH(g)+3H2O(g)發生的適宜條件,現改變氫碳比[n(H2)/n(CO2)]和溫度等條件進行了如下實驗:
根據表中實驗數據分析:
①該反應的正反應為 (填“吸熱”或“放熱”)反應。
②為提高CO2的平衡轉化率,可采取的措施有 (寫出一條即可)。
(3)一定條件下,將3 mol H2 和1mol CO2氣態混合物充入2L 密閉容器中,發生如下反應:3H2(g)+CO2(g)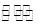 CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是
。
CH3OH(g)+H2O(g)。2min時該反應達到平衡,測得CH3OH的物質的量濃度為0.2mol/L。下列說法正確的是
。
A.該反應的平衡常數表達式為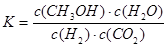
B.CO2的平衡轉化率為40%
C.2min內H2的平均反應速率為0.3mol/(L·min)
D.該反應達到平衡狀態的標志是混合氣體的密度不發生改變
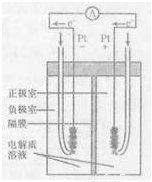
(4)右圖是甲烷燃料電池的工作原理示意圖,電解質溶液為KOH溶液。則負極室通入的氣體是 (填“甲烷”或“氧氣”);正極室電極上發生的電極反應是 ;其電池的總反應為 。比起直接燃燒燃料產生電力,使用燃料電池有許多優點,其中主要有兩點:首先是能量轉化效率高,其次是 。
查看答案和解析>>
科目:高中化學 來源:2013屆山東省濟寧市高二3月月考化學試卷 題型:選擇題
已知鋁與O2、O3在一定條件下均能反應,且都生成Al2O3。反應的熱化學方程式如下:
4Al(s)+ 3O2(g)===2Al2O3(s);△H=-Q1 kJ/mol
4Al(s)+ 2O3(g)===2Al2O3(s);△H=-Q2 kJ/mol。Q1 、Q2均大于0,且Q1 <Q2,下列說法正確的組合是( )
①上述兩個反應均為吸熱反應;
②4mol固態Al和3mol氣態O2所具有的總能量大于2mol固態Al2O3所具有的能量;
③等質量的O2 、O3,O2的能量高; ④等物質的量的O2 、O3,O3的能量高;
⑤由O2生成O3的反應為放熱反應; ⑥由O2生成O3的反應為吸熱反應;
A.①②④ B.②④⑥ C.②③⑤ D.③④⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com