
【題目】某溫度下,在一個2 L的密閉容器中,加入4 mol A和2 mol B進行如下反應3A(g)+2B(g) ![]() 4C(s)+2D(g),反應一段時間后達到平衡,測得生成1.6 mol C,則下列說法正確的是( )
4C(s)+2D(g),反應一段時間后達到平衡,測得生成1.6 mol C,則下列說法正確的是( )
A. 該反應的化學平衡常數表達式是![]()
B. 此時,B的平衡轉化率是40%
C. 增大該體系的壓強,化學平衡常數增大
D. 增加B,B的平衡轉化率增大
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.用過濾的方法可分離碳酸鈣和氯化鈉溶液的混合物
B.為加快過濾,使用玻璃棒攪動漏斗里的液體
C.蒸發食鹽水時,開始析出晶體后用玻璃棒攪拌
D.為加快蒸發的速度,可以加熱至水全部蒸干得到晶體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于硅和二氧化硅的說法不正確的是( )
A.硅在地殼中的含量僅次于氧
B.硅在自然界中既有化合態,又有游離態
C.二氧化硅是石英、水晶的主要成分
D.硅單質的導電能力介于導體和絕緣體之間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g) ![]() 2CO(g),平衡時,體系中氣體體積分數與溫度的關系如圖所示,已知:氣體分壓(p分)=氣體總壓(p總)×體積分數。下列說法正確的是( )
2CO(g),平衡時,體系中氣體體積分數與溫度的關系如圖所示,已知:氣體分壓(p分)=氣體總壓(p總)×體積分數。下列說法正確的是( )
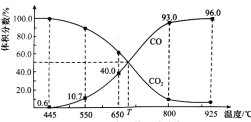
A. 550℃時,若充入惰性氣體,v正,v逆均減小,平衡不移動
B. 650℃時,反應達平衡后CO2的轉化率為25.0%
C. T℃時,若充入等體積的CO2和CO,平衡不移動
D. 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數KP=24.0p總
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容中發生下列反應aA(g)![]() cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.8倍,下列敘述正確的是
cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.8倍,下列敘述正確的是
A. A的轉化率變小 B. 平衡向正反應方向移動
C. D的體積分數變大 D. a> c+d
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物A的結構為 , 下列有關說法正確的是
, 下列有關說法正確的是
A. 1 mol A能跟2 mol NaOH溶液反應
B. 能發生加聚反應
C. 不能發生分子內酯化反應
D. A分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應速率與限度與生產、生活密切相關
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,他在400mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
時間(min) | 1 | 2 | 3 | 4 | 5 |
氫氣體積(mL)(標準狀況) | 100 | 240 | 464 | 576 | 620 |
①哪一時間段(指0~1、1~2、2~3、3~4、4~5min)反應速率最大___________。
②求3~4分鐘時間段以鹽酸的濃度變化來表示的該反應速率______________。(設溶液體積不變)
(2)另一學生也做同樣的實驗,由于反應太快,不好控制測量氫氣體積,他事先在鹽酸中加入等體積的下列溶液以減慢反應速率,你認為不可行的是_________。
A.蒸餾水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某溫度下在4L密閉容器中,3種氣態物質X、Y、Z的物質的量隨時間變化曲線如圖。

①該反應的化學方程式是__________________________。
②在5min時,該反應達到了平衡狀態,下列可作為判斷反應已達到該狀態的是_______。
A.X、Y、Z的反應速率相等
B.容器內氣體壓強保持不變
C.X、Y的反應速率比為3:1
D.生成1mol Y的同時生成2mol Z
③2min內X的轉化率為_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國化學家研究出一種新型復合光催化劑(C3N4/CQDs),能利用太陽光高效分解水,原理如下圖所示。下列說法不正確的是
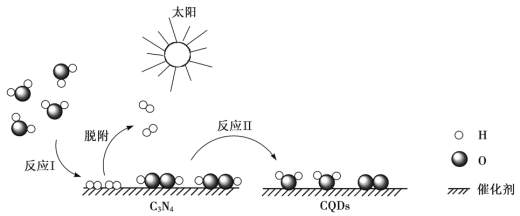
A. 通過該催化反應,實現了太陽能向化學能的轉化
B. 反應I中涉及到非極性鍵的斷裂和極性鍵的形成
C. 反應II為:2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D. 總反應為:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO用途廣泛,工業應用時離不開平衡思想的指導:
Ⅰ、在某一容積為5 L的體積不變的密閉容器內,加入 0.3 mol的CO和0.3 mol的H2O,在催化劑存在和800℃的條件下加熱,發生如下反應:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反應中CO2的濃度隨時間變化情況如右圖:
CO2(g)+H2(g) ΔH>0,反應中CO2的濃度隨時間變化情況如右圖:
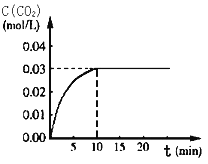
(1)根據圖上數據,該溫度(800℃)下的平衡常數K=________________。
(2)在體積不變的條件下,改變下列條件能使平衡常數K增大的有_____(填字母)
A.升高溫度 B.降低溫度 C.增大壓強D.減小壓強 E.加入催化劑 G.移出一氧化碳氣體
(3)若保持溫度和容器的體積不變,在(1)中上述平衡體系中,再充入0.3mol 的水蒸氣,重新達到平衡后,H2O的轉化率_______(填“升高”、“降低”、“不變”)。
(4)在催化劑存在和800℃的條件下,在某一時刻測得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,則此時正、逆反應速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
Ⅱ、還原法煉鉛,包含反應PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表:
Pb(s)+CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表:
溫度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①該反應的ΔH_______0(選填“>”、“<”或“=”)。
②當lgK=1,在恒容密閉容器中放入PbO并通入CO,達平衡時,混合氣體中CO的體積分數為_____(保留兩位有效數字);若向容器中充入一定量的CO氣體后,平衡發生移動,再次達到平衡時,CO的百分含量_____ (填“增大”、“減小”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com