
分析 (1)配制240mL 0.2mol•L-1 的Na2CO3溶液,應選擇250mL容量瓶,依據m=CVM計算需要溶質的質量;
(2)依據配制一定物質的量濃度一般步驟排序;
(3)分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行誤差判斷;
(4)硫酸過量,碳酸鈉完全反應生成二氧化碳,根據n=cV計算碳酸鈉的物質的量,根據碳原子守恒計算二氧化碳的物質的量,再根據V=nVm計算二氧化碳的體積;根據c=$\frac{n}{V}$計算反應后鈉離子的濃度.
解答 解:(1)配制240mL 0.2mol•L-1 的Na2CO3溶液,應選擇250mL容量瓶,需要Na2CO3•10H2O的質量=0.2mol×0.25L×276g/mol=14.3g;
故答案為:14.3;
(2)配制一定物質的量濃度一般步驟:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻、裝瓶,所以正確的順序為:BCAFED;
故答案為:BCAFED;
(3)所選用的溶質已經變質,部分已失去了結晶水,導致溶質的物質的偏大,溶液濃度偏高,故選;
B.轉移前,容量瓶中含有少量蒸餾水,對溶質的物質的量和溶液體積都不產生影響,溶液濃度不變,故不選;
C.將未冷卻的溶液沿玻璃棒注入容量瓶中,冷卻后溶液體積偏小,溶液濃度偏高,故選;
D.定容時,仰視刻度線導致溶液體積偏大,溶液濃度偏低,故不選;
E.稱量時誤操作為“左碼右物”,依據左盤質量=右盤質量=游碼質量,實際稱取固體質量=14g-0.3g=13.7g,稱取的溶質的質量偏小,溶質的物質的量偏小,溶液濃度偏低,故不選;
F.定容后使溶液混勻靜止,發現凹液面低于刻度線,立即滴蒸餾水至刻度線,導致溶液體積偏大,溶液濃度偏低,故不選;
故選:AC;
(4)125mL0.2mol/LNa2CO3溶液中碳酸鈉的物質的量=0.125L×0.2mol/L=0.025mol,125mL 0.3mol•L-1 的硫酸溶液中硫酸的物質的量=0.125L×0.3mol/L=0.0375mol,故硫酸過量,碳酸鈉完全反應生成二氧化碳,由碳原子守恒可知二氧化碳的物質的量為0.025mol,體積為0.025mol×22.4L/mol=0.56L,即560mL;
反應后溶液中鈉離子物質的量不變,為0.025mol×2=0.05mol,故鈉離子的物質的量濃度=$\frac{0.05mol}{0.25L}$=0.2mol/L,
故答案為:560; 0.2 mol/L.
點評 本題考查了一定物質的量濃度溶液的配制,明確配制原理和步驟是解題關鍵,注意誤差分析的方法,題目難度不大.


 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:選擇題
| A. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| B. | 乙烯與乙醇在濃硫酸作用下共熱反應生成乙酸乙酯 | |
| C. | 苯與溴水混合振蕩,溴水層的顏色變淺 | |
| D. | 苯與氫氣在一定條件下反應生成環已烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
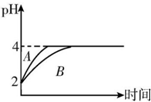 已知t℃時,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.請回答下列問題:
已知t℃時,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 編號 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 玻璃棒 | B. | 膠頭滴管 | C. | 托盤天平 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 原電池原理的發現和各式各樣電池裝置的發明是化學對人類的一項重大貢獻.關于如圖
原電池原理的發現和各式各樣電池裝置的發明是化學對人類的一項重大貢獻.關于如圖| A. | 將電能轉化為化學能的裝置 | B. | 電子由銅片經導線流向鋅片 | ||
| C. | 鋅片為負極,發生氧化反應 | D. | 銅片上發生的反應為Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
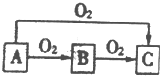 A、B、C是中學化學中常見的三種物質,它們之間的相互轉化關系如圖(部分反應條件及產物)
A、B、C是中學化學中常見的三種物質,它們之間的相互轉化關系如圖(部分反應條件及產物)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com