
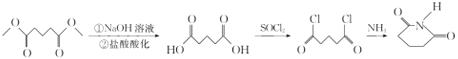
【題目】某研究小組擬合成醫藥中間體X和Y。
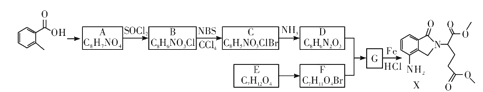
已知:①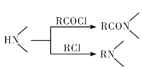 ;
;
②![]() ;
;
③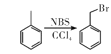 。
。
(1)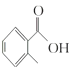 的名稱是__________
的名稱是__________
(2)G→X的反應類型是_____________。
(3)化合物B的結構簡式為_____________。
(4)下列說法不正確的是__________(填字母代號)
A. 化合物A能使酸性KMnO4溶液褪色
B.化合物C能發生加成、取代、消去反應
C.化合物D能與稀鹽酸反應
D.X的分子式是C15H16N2O5
(5)寫出D+F→G的化學方程式:____________________
(6)寫出化合物A(C8H7NO4)同時符合下列條件的兩種同分異構體的結構簡式_______。
①分子是苯的二取代物,1H—NMR譜表明分子中有4種化學環境不同的氧原子;
②分子中存在硝基和![]() 結構。
結構。
(7)參照以上合成路線設計E→![]() 的合成路線(用流程圖表示,無機試劑任選)。
的合成路線(用流程圖表示,無機試劑任選)。
____________________________________________。
【答案】鄰甲基苯甲酸 還原反應 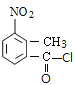 BD
BD 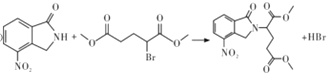
![]() 、
、![]() 、
、![]() 、
、![]()
【解析】
由![]() 、A的分子式,縱觀整個過程,結合X的結構,可知
、A的分子式,縱觀整個過程,結合X的結構,可知![]() 發生甲基鄰位硝化反應生成A為
發生甲基鄰位硝化反應生成A為 ,對比各物質的分子,結合反應條件與給予的反應信息,可知A中羧基上羥基被氯原子取代生成B,B中甲基上H原子被溴原子取代生成C,C中氯原子、溴原子被-NH-取代生成D,故B為
,對比各物質的分子,結合反應條件與給予的反應信息,可知A中羧基上羥基被氯原子取代生成B,B中甲基上H原子被溴原子取代生成C,C中氯原子、溴原子被-NH-取代生成D,故B為 、C為
、C為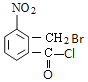 、D為
、D為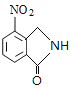 。由X的結構,逆推可知G為
。由X的結構,逆推可知G為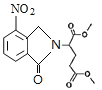 ,結合F、E的分子式,可推知F為CH3OOCCHBrCH2CH2COOCH3、E為CH3OOCCH2CH2CH2COOCH3。
,結合F、E的分子式,可推知F為CH3OOCCHBrCH2CH2COOCH3、E為CH3OOCCH2CH2CH2COOCH3。
根據上述分析可知:A為 ;B為
;B為 ;C為
;C為 ;D為
;D為 ;E為CH3OOCCH2CH2CH2COOCH3;F為CH3OOCCHBrCH2CH2COOCH3;G為
;E為CH3OOCCH2CH2CH2COOCH3;F為CH3OOCCHBrCH2CH2COOCH3;G為 。
。
(1)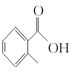 的甲基在苯環羧基的鄰位C原子上,因此其名稱是鄰甲基苯甲酸;
的甲基在苯環羧基的鄰位C原子上,因此其名稱是鄰甲基苯甲酸;
(2)G變X是-NO2變為-NH2,發生的是還原反應;
(3)化合物B的結構簡式為 ;
;
(4)A.化合物A的苯環上有甲基,能酸性KMnO4溶液氧化,因而可以使酸性KMnO4溶液褪色,A正確;
B.化合物C結構簡式是 ,含苯環與羰基能發生加成反應,有Br原子可以發生取代反應;由于Br原子連接的C原子直接連接在苯環上,因此不能發生消去反應,B錯誤;
,含苯環與羰基能發生加成反應,有Br原子可以發生取代反應;由于Br原子連接的C原子直接連接在苯環上,因此不能發生消去反應,B錯誤;
C.化合物D 含有亞氨基,能與稀鹽酸反應,C正確;
含有亞氨基,能與稀鹽酸反應,C正確;
D.根據物質的結構簡式可知X的分子式是C15H18N2O5,D錯誤;
故合理選項是BD;
(5)D+F→G的化學方程式為: ;
;
(6)化合物A(C8H7NO4)的同分異構體同時符合下列條件:①分子是苯的二取代物,1H-NHR譜表明分子中有4種化學環境不同的氫原子,存在對稱結構;②分子中存在硝基和酯基結構,2個取代基可能結構為:-NO2與-CH2OOCH、-NO2與-CH2COOH、-COOH與-CH2NO2、-OOCH與-CH2NO2,同分異構體可能結構簡式為![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(7)由E(CH3OOCCH2CH2CH2COOCH3)先在NaOH溶液中發生水解反應,然后酸化可得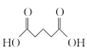 ,該物質與SOCl2發生反應產生
,該物質與SOCl2發生反應產生![]() ,
,![]() 與NH3發生反應得到目標產物
與NH3發生反應得到目標產物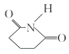 ,故由E合成
,故由E合成 的路線為:
的路線為: 。
。


科目:高中化學 來源: 題型:
【題目】熱激活電池可用作火箭、導彈的工作電源。一種熱激活電池的基本結構如圖所示,其中作為電解質的無水LiCl-KCl混合物受熱熔融后,電池即可瞬間輸出電能,此時硫酸鉛電極處生成Pb。下列有關說法正確的是
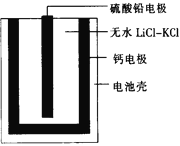
A. 輸出電能時,外電路中的電子由硫酸鉛電極流向鈣電極
B. 放電時電解質LiCl-KCl中的Li+向鈣電極區遷移
C. 電池總反應為Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每轉移0.2 mol電子,理論上消耗42.5 g LiCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門以實驗為基礎的學科,實驗是進行科學探究的重要方式,認識常見的化學實驗儀器是學生必備的學科素養之一。寫出題中指定的化學實驗儀器的名稱。

A.________B.________C.________D.________E.________F.________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是
A.實驗中需2.00mol·L-1的NaCl溶液950mL,配制時應稱取的質量是117.0g
B.標準狀況下,11.2LHCl氣體溶于水配成1L溶液,其濃度為0.5mol/L
C.將4g氫氧化鈉溶于1L水中,所形成溶液濃度為0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,則溶液中SO42-的物質的量濃度為7.5mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】文獻表明:工業上,向熾熱鐵屑中通入氯化氫生產無水氯化亞鐵;相同條件下,草酸根(C2O42-)的還原性強于Fe2+。為檢驗這一結論,雅禮中學化學研究性小組進行以下實驗:
資料:i. 草酸(H2C2O4)為二元弱酸。
ii. 三水三草酸合鐵酸鉀[K3Fe(C2O4)33H2O]為翠綠色晶體,光照易分解。其水溶液中存在[Fe(C2O4)3]3-![]() Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii.FeC2O42H2O為黃色固體,溶于水,可溶于強酸。
(實驗1)用以下裝置制取無水氯化亞鐵
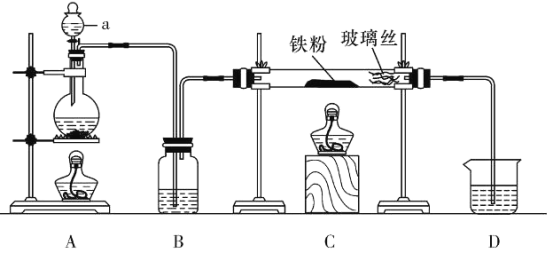
(1)儀器a的名稱為___________。
(2)欲制得純凈的FeCl2,實驗過程中點燃A、C酒精燈的先后順序是___________。
(3)若用D的裝置進行尾氣處理,存在的問題是__________、___________。
(實驗2)通過Fe3+和C2O42-在溶液中的反應比較Fe2+和C2O42-的還原性強弱。

(4)取實驗2中少量晶體洗浄,配成溶液,漓加KSCN溶液,不變紅。繼續加入硫酸,溶液變紅,說明晶體中含有+3價的鐵元素。加硫酸后溶液變紅的原因是______________。
(5)經檢驗,翠綠色晶體為K3Fe(C2O4)33H2O。設計實驗,確認實驗2中沒有發生氧化還原反應的操作和現象是_____。
(6)取實驗2中的翠綠色溶液光照一段時間,產生黃色渾濁且有氣泡產生。補全反應的離子方程式:_____Fe(C2O4)3]3-+____H2O![]() ____FeC2O4·2H2O↓+__________+_______
____FeC2O4·2H2O↓+__________+_______
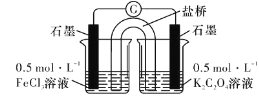
(實驗3)研究性小組又設計以下裝置直接比較Fe2+和C2O42-的還原性強弱,并達到了預期的目的。
(7)描述達到期目的可能產生的現象:_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)碳能與氫、氮、氧三種元素組成化合物CO(NH2)2,該物質易溶于水的主要原因是____。
(2)碳元素能形成多種無機物。
①CO32-的立體構型是________。
②MgCO3分解溫度比CaCO3低的原因是___________。
(3)圖①為嘌呤的結構,嘌呤中軌道之間的夾角∠1比∠2大,請解釋原因:____________。
(4)圖②為碳的一種同素異形體C60分子,每個C60分子中含有![]() 鍵的數目為________。
鍵的數目為________。
(5)圖③為碳的另一種同素異形體一一金剛石的晶胞結構,其中原子坐標參數A為(0,0,0),B為(![]() ),C為(
),C為(![]() );則D原子的坐標參數為________。
);則D原子的坐標參數為________。
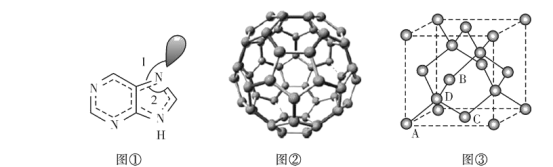
(6)副族元素Mn和元素Se形成的某化合物屬于立方晶系,其晶胞結構如圖①所示,其中(〇為Se,●為Mn),則Se的配位數為____,Mn和Se的摩爾質量分別為M1 g/mol、M2 g/mol,該晶體的密度為![]() g/cm3,則Mn-Se鍵的鍵長為_____nm(寫表達式即可)。
g/cm3,則Mn-Se鍵的鍵長為_____nm(寫表達式即可)。
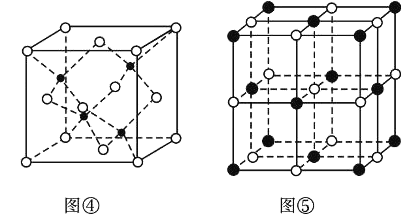
(7)KI的晶胞結構如圖⑤所示,已知其晶體的密度為![]() g/cm3,K和I的摩爾質量分別為Mk gmol-1和MI gmol-1,原子半徑分別為rk pm和rI pm,阿伏加德羅常數的值為NA,則KI晶胞中原子的體積占晶胞體積的百分率為______(寫表達式即可)。
g/cm3,K和I的摩爾質量分別為Mk gmol-1和MI gmol-1,原子半徑分別為rk pm和rI pm,阿伏加德羅常數的值為NA,則KI晶胞中原子的體積占晶胞體積的百分率為______(寫表達式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三種短周期元素x、y、z對應的單質X、Y、Z,常溫常壓下均為無色氣體,在適當條件下單質X、Y、Z之間可以發生如圖所示的變化。已知B分子組成中z原子個數比C分子中多一個。

請回答下列問題:
(1)元素x的原子結構示意圖___;元素y在周期表中的位置是___;
(2)寫出單質氟與C反應的離子反應方程式:___。
(3)Y與X在一定條件下生成化合物A的化學方程式:___。
(4)一定條件下,將盛有10mLA的大試管倒置于水槽的水中然后緩緩通入Y至液體剛好充滿試管,寫出反應的化學方程式___;通入相同狀況下氣體Y的體積為___。
(5)用電子式表示B的形成過程___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有研究表明,內源性H2S作為氣體信號分子家族新成員,在抗炎、舒張血管等方面具有重要的生理作用,而籠狀COS(羰基硫)分子可作為H2S的新型供體(釋放劑)。試回答下列有關問題
(1)COS的分子結構與CO2相似,COS的結構式為______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,則△H=______。
(3)COS可由CO和H2S在一定條件下反應制得。在恒容的密閉容器中發生反應并達到平衡:CO(g)+H2S(g)COS(g)+H2(g),數據如表所示、據此填空
實驗 | 溫度/℃ | 起始時 | 平衡時 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①該反應為______(選填“吸熱反應”或“放熱反應”)。
②實驗2達到平衡時,x______7.0(選填“>”、“<”或“=”)
③實驗3達到平衡時,CO的轉化率α=______
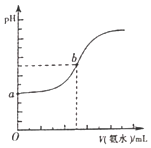
(4)已知常溫下,H2S和NH3H2O的電離常數分別為向pH=a的氫硫酸中滴加等濃度的氨水,加入氨水的體積(V)與溶液pH的關系如圖所示:
酸/堿 | 電離常數 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)為0.1mol/L,則a=______
②若b點溶液pH=7,則b點溶液中所有離子濃度大小關系是______。
(5)將H2S通入裝有固體FeCl2的真空密閉燒瓶內,恒溫至300℃,反應達到平衡時,燒瓶中固體只有FeCl2和FeSx(x并非整數),另有H2S、HCl和H2三種氣體,其分壓依次為0.30P0、0.80P0和0.04P0(P0表示標準大氣壓)。當化學方程式中FeCl2的計量數為1時,該反應的氣體壓強平衡常數記為Kp。計算:
①x=______(保留兩位有效數字)。
②Kp=______(數字用指數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置能達到實驗目的的是
A.除去淀粉溶液中的NaCl 
B.比較NaHCO3和Na2CO3的熱穩定性
C.制備Fe(OH)2 
D.測定過氧化鈉的純度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com