
| A. | 將1molCl2通入水中,HClO、Cl-、ClO-粒子數之和為2NA | |
| B. | 分子數目為0.1NA的CH4和NH3混合氣體,原子間含有的共用電子對數目為0.4NA | |
| C. | 25℃時,PH=13的Ba(OH)2溶液中含有氫氧根離子數為0.1NA | |
| D. | 將1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+數目為NA |
分析 A.氯氣溶于水,部分與水反應,部分以氯氣分子形式存在;
B.1個氨氣分子含有4對共用電子對,1個氨氣分子含有3對共用電子對;
C.溶液體積未知;
D.依據電荷守恒判斷.
解答 解:A.氯氣溶于水,部分與水反應,部分以氯氣分子形式存在,依據氯原子個數守恒,將1molCl2通入水中,HClO、Cl-、ClO-粒子數之和小于2NA,故A錯誤;
B.1個氨氣分子和1個甲烷分子含有共用電子對數不同,無法計算0.1mol混合物含有電子對數,故B錯誤;
C.溶液體積未知,無法計算微粒個數,故C錯誤;
D.將1mol NH4NO3溶于稀氨水中使溶液呈中性,則溶液中存在電荷守恒:[H+]+[NH4+]=[NO3-]+[OH-],溶液呈中性,則銨根離子濃度等于硝酸根離子濃度,溶液體積相等,則氨根離子數目等于硝酸根離子數,為1mol,溶液中NH4+數目為NA,故D正確;
故選:D.
點評 本題考查阿伏加德羅常數的綜合應用,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加得羅常數的關系,注意溶液中電荷守恒的應用.


科目:高中化學 來源: 題型:選擇題
| A. | 氧化性:A2>B2>C2>D2 | B. | 還原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反應不可以進行 | D. | 2C-+B2═2B-+C2反應能進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=l的溶液:Ba2+、Al3+、Cl-、SO42- | |
| B. | 能使酚酞試液變紅的溶液:Na+、K+、HCO3-、I- | |
| C. | c(OH-)/c(H+)=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 含有0.1mol/LFe(NO3)2的溶液:H+、Mg2+、SCN-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵和銅在自然界中主要以游離態的形式存在 | |
| B. | 工業上在高溫下用CO還原含Fe2O3的鐵礦石煉鐵 | |
| C. | 常溫下鐵與濃硫酸不反應 | |
| D. | 用激光照射硫酸銅溶液可觀察到丁達爾現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 符合分子通式CnH2n+2的烴一定都是烷烴,分子中均只含單鍵 | |
| B. | 通過石油裂化可以得到多種氣態短鏈烴,其中包括重要化工原料 | |
| C. | 苯能使溴水褪色,說明苯環結構中含有碳碳雙鍵 | |
| D. | 乙醇可以被氧氣氧化成乙酸,但乙酸無法再被氧氣氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
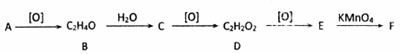
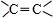 ,其產量可以用來衡量一個國家石油化工的發展水平.
,其產量可以用來衡量一個國家石油化工的發展水平.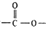 ,且無環狀結構的同分異構體有8種.(不考慮立體異構)
,且無環狀結構的同分異構體有8種.(不考慮立體異構)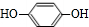 .
.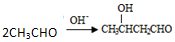 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗 | 現象 | 結論 |
| A | 向FeBr2溶液中加入少量氯水,再加 CCl4振蕩 | CCl4層無色 | Fe2+的還原性強于Br- |
| B | 向鹽酸中滴入少量NaAlO2溶液 | 無明顯現象 | AlO2-與H+未發生反應 |
| C | 向某溶液里滴加NaOH溶液并將濕潤的紅色石蕊試紙罝于試管口 | 試紙顏色無 明顯變化 | 原溶液中無NH4+ |
| D | 常溫下,測定等物質的量濃度的 Na2CO3和Na2SO3溶液的pH | 前者的pH 比后者的大 | 元素非金屬性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 內容 | 評價 |
| A | 一定條件下0.5molN2和1.5molH2反應,平衡時放熱akJ, 則N2(g)+3H2(g)?2NH3(g)+2aKJ | 正確 |
| B | 氯化鎂溶液與氨水反應:Mg2++2OH-→Mg(OH)2↓ | 錯誤,氨水不應寫成離子形式 |
| C | 向硫酸銨溶液中加入氫氧化鋇溶液:Ba2++SO42-→BaSO4↓ | 正確 |
| D | 等物質的量的Cl2與Na2SO3在溶液中反應:SO32-+Cl2→SO42-+2Cl- | 正確 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com