
【題目】氮及其化合物是科學家們一直在探究的問題,它們在工農業生產和生命活動中起著重要的作用。回答下列問題。
Ⅰ.已知H—H鍵的鍵能為a kJ·mol-1,N—H鍵的鍵能為bkJ·mol-1,N![]() N鍵的鍵能是ckJ·mol-1,則反應NH3(g)
N鍵的鍵能是ckJ·mol-1,則反應NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=____kJ·mol-1,若在某溫度下其平衡常數為K,則N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某溫度下其平衡常數為K,則N2(g)+3H2(g)![]() 2NH3(g)的平衡常數K1=____(用K表示)。
2NH3(g)的平衡常數K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的飲用水二級消毒劑。
(1)用Cl2和NH3反應制備三氯胺的方程式為3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容積均為1L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2molCl2和2molNH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
NCl3(l)+3HCl(g),向容積均為1L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2molCl2和2molNH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),該反應的ΔH___0(填“>”或“<”)。
②該反應自發行的條件是____(填高溫、低溫、任何溫度)。
③對該反應,下列說法正確的是___(填選項字母)。
A.若容器內氣體密度不變,則表明反應達到平衡狀態
B.若容器內Cl2和NH3物質的量之比為3∶1,則表明反應達到平衡狀態
C.反應達平衡后,其他條件不變,加入一定量的NCl3,平衡將向逆反應方向移動
D.反應達到平衡后,其他條件不變,在原容器中按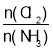 =1繼續充入一定量反應物,達新平衡后Cl2的轉化率增大
=1繼續充入一定量反應物,達新平衡后Cl2的轉化率增大
(2)工業上可利用反應2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制備二氯胺。
NHCl2 (l)+2HCl(g)制備二氯胺。
①NHCl2在中性、酸性環境中會發生強烈水解,生成具有強殺菌作用的物質,寫出該反應的化學方程式____。
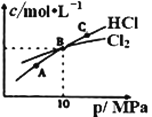
②在恒溫條件下,將2molCl2和1molNH3充入某密閉容器中發生上述反應,測得平衡時Cl2和HCl的物質的量濃度與平衡總壓的關系如圖所示。則A、B、C三點中Cl2轉化率最高的是___點(填“A”“B”或“C”);B點時反應物轉化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B點平衡體積為2L,則平衡常數K=____。
【答案】3b-![]() c-
c-![]() a
a ![]() > < 低溫 AD NHCl2+2H2O=2HClO+NH3 C = 4
> < 低溫 AD NHCl2+2H2O=2HClO+NH3 C = 4
【解析】
Ⅰ.焓變=反應物的總鍵能-生成物的總鍵能,據此計算,平衡常數K=![]() ,正逆反應的平衡常數互為倒數;
,正逆反應的平衡常數互為倒數;
Ⅱ.(1)①溫度越高,反應速率越快;根據數據,在400℃時,甲容器,平衡后0.8mol,乙容器中1.00mol,達到平衡時間短說明反應速率大,乙中剩余氯氣應少,但氯氣增多說明溫度升高影響平衡逆向進行;
②反應自發進行的判斷依據為△H-T△S<0,結合反應特征分析判斷;
③可逆反應到達平衡時,同種物質的正逆速率相等,各組分的濃度、含量保持不變,由此衍生的其它一些量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化說明到達平衡;
(2)①根據元素守恒可推測出具有強烈殺菌作用的物質為HClO,據此寫出反應;
②體系中HCl的濃度越大則Cl2轉化率越大;起始量2molCl2和1molNH3,根據方程式可知Cl2和NH3按照2:1的比例進行反應,所以轉化率始終相同;B點處HCl和Cl2的濃度相同,據此反推各物質的濃度進行平衡常數的計算;
Ⅰ.已知:H-H鍵能為akJmol-1,H-N鍵能為bkJmol-1,N≡N鍵的鍵能ckJmol-1,對于反應NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的△H=反應物的總鍵能-生成物的總鍵能=3b-
H2(g)的△H=反應物的總鍵能-生成物的總鍵能=3b-![]() c-
c-![]() a,其平衡常數為K=
a,其平衡常數為K= ,則N2(g)+3H2(g)2NH3(g)的平衡常數K1=
,則N2(g)+3H2(g)2NH3(g)的平衡常數K1=![]() ,故答案為:3b-
,故答案為:3b-![]() c-
c-![]() a;
a;![]() ;
;
Ⅱ.(1)①溫度越高,反應速率越快,平衡向吸熱反應方向移動,其他條件相同時,T℃時的反應速率比400℃時的反應速率快,則T℃>400℃;根據數據,在400℃時,甲容器,平衡后0.8mol,乙容器中1.00mol,達到平衡時間短說明反應速率大,乙中剩余氯氣應少,但氯氣增多說明溫度升高影響平衡逆向進行,△H<0,故答案為:>;<;
②3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),反應的△S<0,△H<0,滿足△H-T△S<0,需要低溫下,反應能自發進行,故答案為:低溫;
③A.NCl3(l)為液體,反應前后氣體質量變化,氣體體積不變,若容器內氣體密度不變,則表明反應達到平衡狀態,故A正確;
B.起始量2molCl2和2molNH3,根據方程式可知反應過程中Cl2和NH3按照3:1的比例進行反應,所以容器內的Cl2和NH3物質的量之比不可能為3:1,故B錯誤;
Cspan>.反應達到平衡后,其他條件不變,加入一定量的NCl3(l)為液體不影響此平衡的移動,故C錯誤;
D.反應達到平衡后,其他條件不變,在原容器中按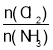 =1繼續充入一定量反應物,壓強增大,平衡正向進行,Cl2的轉化率增大,故D正確;
=1繼續充入一定量反應物,壓強增大,平衡正向進行,Cl2的轉化率增大,故D正確;
故答案為:AD。
(2)①根據元素守恒可推測出具有強烈殺菌作用的物質為HClO,所以二氯胺與水反應方程式為:NHCl2+2H2O=2HClO+2NH3;
②容器為密閉容器,據圖可知C點處HCl的濃度最大,體系中HCl的濃度越大則Cl2轉化率越大,所以C點Cl2轉化率最高;起始量2molCl2和1molNH3,根據方程式可知Cl2和NH3按照2:1的比例進行反應,所以轉化率始終相同;B點處HCl和Cl2的濃度相同,設平衡時c(HCl)=amol/L,初始c(Cl2)=![]() ,c(NH3)=
,c(NH3)=![]() ,則
,則

則有1-a=a,解得a=0.5mol/L,所以平衡時c(HCl)=0.5mol/L,c(Cl2)=0.5mol/L,c(NH3)=0.25mol/L,平衡常數K=![]() ,故答案為:C;=;4;
,故答案為:C;=;4;


科目:高中化學 來源: 題型:
【題目】磷酸氯喹在細胞水平上能有效抑制新型冠狀病毒(2019-nCOV)的感染,其結構如圖所示。下列說法錯誤的是
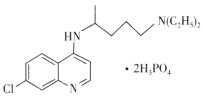
A.基態C1原子的核外電子有17種運動狀態
B.C、N、O、P四種元素中電負性最大的是O
C.H3PO4分子中磷原子的價層電子對數為4
D.與足量H2發生加成反應后,該分子中手性碳原子個數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、磷、砷、鐵等元素及其化合物在現代農業、科技、國防建設中有著許多獨特的用途。
(1)基態砷原子中核外電子占據最高能層的符號為__,該能層的原子軌道數有__個。
(2)氮的一種氫化物N2H4是一種良好的火箭發射燃料,傳統制備肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔點、沸點分別為1.4℃、113.5℃,氨氣的熔點、沸點分別為-77.7℃、-33.5℃。
①N2H4中氮原子的雜化軌道類型為__雜化,基態N原子電子占據最高能級的電子云輪廓圖為___形。
②肼與氨氣熔點、沸點差異最主要的原因是__。
(3)氨分子是一種常見配體,配離子[Co(NH3)6]3+中存在的化學鍵有__(填序號)。
A.離子鍵 B.極性鍵 C.配位鍵 D.氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列表述正確的是
A.鋼鐵吸氧腐蝕中的正極反應:4OH 4e-=2H2O +O2↑
B.工業上用電解法制鎂:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
C.使pH試紙顯藍色的溶液中:Na+、Mg2+、ClO-、HSO3-能大量共存
D.![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是( )
A. 常溫、常壓下,4.6 g NO2和N2O4混合氣體中含有的氧原子數目為0.2NA
B. 1 mol的羥基與1 mol的氫氧根離子所含電子數均為10NA
C. 將0.1 mol FeCl3溶于1 L水中,所得溶液含Fe3+離子數目為0.1NA
D. 在高溫下,1 mol Fe與足量的水蒸氣反應,轉移電子的數目為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2 L的密閉容器中,X、Y、Z三種氣體隨時間變化的曲線如圖所示。
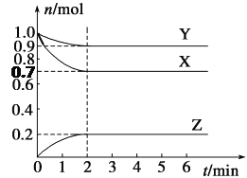
請回答下列問題:
(1)由圖中數據該反應的化學方程式為_____________________。
(2)反應開始至2 min,Z的平均反應速率為____,此時X的轉化率為_____。
(3)5 min時Z的生成速率與6 min時Z的生成速率相比較,前者______后者(填“大于”、“小于”或“等于”)。
(4)對于該反應,能增大正反應速率的的措施是________
A.增大容器容積 B.移走部分Y C.通入大量X D.升高溫度 E.加催化劑
(5)此反應在三種不同情況下的反應速率分別為:
①v(X)=6mol/(L·min) ②v(Y)= 6 mol/(L·min) ③v(Z)=8 mol/(L·min)
其中反應速率最快的是________(填編號)。
(6)下列各項中不可以說明上述反應達到平衡的是______(填字母)。
a.混合氣體的密度不變
b.混合氣體的壓強不變
c.同一物質的正反應速率等于逆反應速率
d.X的濃度保持不變
e.生成1 mol Z和同時生成1.5 mol X
f.X、Y、Z的反應速率之比為3∶1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,針對表中的①~⑩種元素,回答下列問題:
主族周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素①的名稱是______;元素②在周期表中所處位置________。
(2)元素②的簡單氫化物的結構式為________;
(3)用電子式表示元素⑤與⑦的化合物的形成過程:__________________。
(4)表示④與⑨按原子個數比1:1形成的化合物的電子式:______,該化合物中含有的化學鍵的類型______。
(6)④、⑥、⑦、⑨四種元素形成的簡單離子,離子半徑由大到小的順序是_____(請用離子符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)實驗室在配制Cu(NO3)2的溶液時,常將Cu(NO3)2固體先溶于較濃的硝酸中,再用蒸餾水稀釋到所需的濃度,其目的是_________
(2)FeCl3凈水的原理是(用離子方程式表示)_________將AlCl3溶液蒸干,灼燒,最后得到的主要固體產物是______(寫化學式)
(3)已知草酸是二元弱酸,常溫下測得0.1mol/L的KHC2O4的pH為4.8,則此KHC2O4溶液中c(C2O42-)____c(H2C2O4) (填“大于”或“小于”或“等于”)
(4)泡沫滅火器內裝有NaHCO3飽和溶液,該溶液呈現堿性的原因是(用離子方程式表示)______ ;滅火器內另一容器中裝有Al2(SO4)3溶液,該溶液呈酸性的原因是(用離子方程式表示)_______,當意外失火時,使泡沫滅火器倒過來搖動即可使藥液混合,噴出大量的白色泡沫,阻止火勢蔓延,其相關的離子方程式為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知實驗室用濃硫酸和乙醇在一定溫度下制備乙烯,某學習小組設計實驗利用以下裝置證明濃硫酸在該反應中的還原產物有SO2,并制備1,2-二溴乙烷。
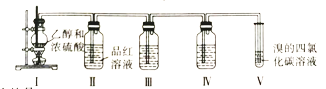
下列說法正確的是
A.濃硫酸在該反應中主要作用是催化劑、脫水劑
B.裝置III、IV中的試劑依次為酸性高錳酸鉀溶液、品紅溶液
C.實驗完畢后,采用萃取分液操作分離1,2-二溴乙烷
D.裝置II中品紅溶液褪色體現了SO2的還原性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com