
實驗室常用MnO2與濃鹽酸反應制備Cl2(反應裝置如圖所示)。

(1)制備實驗開始時,先檢查裝置氣密性,接下來的操作依次是__________(填序號)。
A.往燒瓶中加入MnO2粉末 B.加熱 C.往燒瓶中加入濃鹽酸
制備反應會因鹽酸濃度下降而停止。為測定已分離出過量MnO2后的反應殘余液中鹽酸的濃度,探究小組同學提出的下列實驗方案:
甲方案:與足量AgNO3溶液反應,稱量生成的AgCl質量。
乙方案:與已知量CaCO3(過量)反應,稱量剩余固體的質量。
丙方案:與足量Zn反應,測量生成的H2體積。
繼而進行下列判斷和實驗:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的實驗發現,固體中含有MnCO3,說明碳酸鈣在水中存在__________________,測定的結果會:______________________(填“偏大”、“偏小”或“準確”)。
進行丙方案實驗:裝置如圖所示(夾持器具已略去)。
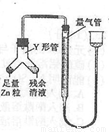
(4)使Y形管中的殘余清液與鋅粒反應的正確操作是將________轉移到______中。
(5)反應完畢,每間隔1分鐘讀取氣體體積,發現氣體體積逐漸減小,直至不變。 氣體體積逐次減小的原因是____________(排除裝置和實驗操作的影響因素)。
(6)小組內又有同學提出還可采用酸堿中和滴定法測定殘余液中鹽酸的濃度,但還需經查閱資料知道:________________________________________________________ 。
(本題共12分,每小題2分) (1)ACB
(2)殘余溶液中,只能計算出Cl-的量,而不能算出H+的量,且n(Cl-)>n(H+)
(3)溶解平衡,偏小;
(4)Zn粒;殘余清液(按序寫出兩項)
(5)裝置內氣體尚未冷至室溫
(6)Mn2+開始沉淀時的pH
【解析】
試題分析:(1)加藥順序一般是先加入固體藥品,再加入液藥品,最后再加熱。檢查裝置氣密性后,先加入固體,再加入液體:濃鹽酸,最后然后加熱,因此依次順序是ACB。
(2)由于加入足量的硝酸銀溶液只能求出氯離子的量,而不能求出剩余鹽酸的濃度,且n(Cl-)>n(H+),所以與足量AgNO3溶液反應,稱量生成的AgCl質量方案是不可行的。
(3)由于碳酸鈣在溶液中存在溶解平衡,固體中含有MnCO3,這說明碳酸錳的Ksp比碳酸鈣的Ksp小。由于部分碳酸鈣轉化成碳酸錳沉淀,因此稱量剩余的固體質量會偏大,這樣一來反應的固體減少,實驗結果偏小。
(4)使Zn粒進入殘余清液中讓其發生反應.這樣殘余清液就可以充分反應.如果反過來,殘余清液不可能全部轉移到左邊,因此導致反應不完全。
(5)由于氣體的體積受溫度影響,所以反應完畢后,每間隔1分鐘讀取氣體體積,氣體體積逐漸減小的原因是氣體未冷卻到室溫,當溫度冷卻到室溫后,氣體體積不再改變。
(6)采用酸堿中和滴定法測定殘余液中鹽酸的濃度,堿滴定溶液先和酸反應后再和氯化錳反應生成氫氧化錳沉淀,需要知道錳離子開始沉淀時的pH才能計算鹽酸消耗的氫氧化鈉,從而計算剩余鹽酸的量。
考點:考查氯氣制備原理和操作、中和滴定的實驗操作和原理以及實驗方案設計與評價等


科目:高中化學 來源: 題型:閱讀理解
 (2012?福建)實驗室常用MnO2與濃鹽酸反應制備Cl2(發生裝置如圖1所示).
(2012?福建)實驗室常用MnO2與濃鹽酸反應制備Cl2(發生裝置如圖1所示).查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
| 濃硫酸 |
| 加熱 |
| 濃硫酸 |
| 加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:
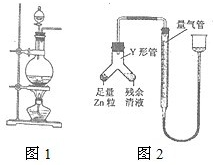 實驗室常用MnO2與濃鹽酸反應制備Cl2(反應裝置如圖1所示).
實驗室常用MnO2與濃鹽酸反應制備Cl2(反應裝置如圖1所示).查看答案和解析>>
科目:高中化學 來源:上海市長寧區2013年高考一模化學試題 題型:058
實驗室常用MnO2與濃鹽酸反應制備Cl2(反應裝置如下圖所示).

1.制備實驗開始時,先檢查裝置氣密性,接下來的操作依次是(填序號).
A.往燒瓶中加入MnO2粉末
B.加熱
C.往燒瓶中加入濃鹽酸
制備反應會因鹽酸濃度下降而停止.為測定已分離出過量MnO2后的反應殘余液中鹽酸的濃度,探究小組同學提出的下列實驗方案∶
甲方案∶與足量AgNO3溶液反應,稱量生成的AgCl質量.
乙方案∶與已知量CaCO3(過量)反應,稱量剩余固體的質量.
丙方案∶與足量Zn反應,測量生成的H2體積.
繼而進行下列判斷和實驗∶
2.判定甲方案不可行,理由是________.
3.乙方案的實驗發現,固體中含有MnCO3,說明碳酸鈣在水中存在________,測定的結果會∶(填“偏大”、“偏小”或“準確”).
進行丙方案實驗∶裝置如下圖所示(夾持器具已略去).

4.使Y形管中的殘余清液與鋅粒反應的正確操作是將轉移到________中.
5.反應完畢,每間隔1分鐘讀取氣體體積,發現氣體體積逐漸減小,直至不變.氣體體積逐次減小的原因是________(排除裝置和實驗操作的影響因素).
6.小組內又有同學提出還可采用酸堿中和滴定法測定殘余液中鹽酸的濃度,但還需經查閱資料知道∶________.
查看答案和解析>>
科目:高中化學 來源: 題型:
實驗室常用MnO2與濃鹽酸反應制備Cl2(反應裝置如右圖所示)。
 (1)制備實驗開始時,先檢查裝置氣密性,接下來的操作依次是 (填序號)。
(1)制備實驗開始時,先檢查裝置氣密性,接下來的操作依次是 (填序號)。
A.往燒瓶中加入MnO2粉末
B.加熱
C.往燒瓶中加入濃鹽酸
(2)制備反應會因鹽酸濃度下降而停止。為測定反應殘余液中鹽酸的濃度,探究小組同學提出的下列實驗方案:
甲方案:與足量AgNO3溶液反應,稱量生成的AgCl質量。
乙方案:采用酸堿中和滴定法測定。
丙方案:與已知量CaCO3(過量)反應,稱量剩余的CaCO3質量。
丁方案:與足量Zn反應,測量生成的H2體積。
繼而進行下列判斷和實驗:
①判定甲方案不可行,理由是 。
②進行乙方案實驗:準確量取殘余清液稀釋一定的倍數后作為試樣。
a.量取試樣20.00mL,用0.1000 mol·L—1NaOH標準溶液滴定,消耗22.00mL,該次滴定測的試樣中鹽酸濃度為 mol·L—1;
b.平行滴定后獲得實驗結果。
 ③判斷丙方案的實驗結果 (填“偏大”、“偏小”或“準確”)。
③判斷丙方案的實驗結果 (填“偏大”、“偏小”或“準確”)。
[已知:Ksp(CaCO3)=2.8×![]() 、Ksp(MnCO3)=2.3×
、Ksp(MnCO3)=2.3×![]() ]
]
④進行丁方案實驗:裝置如右圖所示(夾持器具已略去)。
(i)使Y形管中的殘余清液與鋅粒反應的正確操作是將 轉移到 中。
(ii)反應完畢,每間隔1分鐘讀取氣體體積、氣體體積逐漸減小,直至不變。氣體體積逐次減小的原因
是 (排除儀器和實驗操作的影響因素)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com