
【題目】在密閉容器中發生下列反應aA(g) ![]() cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.8倍,下列敘述正確的是
cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.8倍,下列敘述正確的是
A. A的轉化率變大
B. 平衡向正反應方向移動
C. D的體積分數變大
D. a < c+d
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列有關膠體的敘述正確的是( )
A. 直徑介于1-100nm之間的微粒稱為膠體
B. 有色玻璃、霧都不是膠體
C. 涂料、顏料、墨水的制造,明礬凈水和膠體有關
D. 硅酸膠體加入過量的氫氧化鈉溶液由于膠體聚沉而形成硅酸沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. ![]() 和
和![]() 互為同素異形體 B. 紅磷和白磷互為同位素
互為同素異形體 B. 紅磷和白磷互為同位素
C. 鄰二甲苯和對二乙苯互為同系物 D. CH3C(CH3)2CH3和![]() 互為同分異構體
互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應N2(g)+3H2(g) ![]() 2NH3(g) △H<0.達到平衡后,以下分析正確的是
2NH3(g) △H<0.達到平衡后,以下分析正確的是
A. 增大壓強,對正反應的反應速率影響更大
B. 升高溫度,對正反應的反應速率影響更大
C. 減小反應物濃度,對逆反應的反應速率影響更大
D. 加入催化劑,對逆反應的反應速率影響更大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氯酸鉀和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯,其化學方程式為:2KClO3+4HCl(濃)═2KCl+2ClO2↑+Cl2↑+2H2O
①用單線橋表示上述反應中電子轉移的方向和數目_____________________;
②濃鹽酸在該反應中表現的性質是______(填序號);
A.只有還原性 B.還原性和酸性 C.只有氧化性 D.氧化性和酸性
③該反應的還原產物是______________(填化學式);
④上述反應產生0.1 mol Cl2時,轉移電子的物質的量為______________。
(2)實驗室可以用高錳酸鉀和濃鹽酸反應制取氯氣,反應的化學方程式為:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
①在該反應中,氧化劑與還原劑的物質的量之比是_________________;
②KMnO4的氧化性比Cl2的氧化性______________;
③若在反應中生成了標況下2.24L氯氣,則電子轉移的個數是______NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】飼養金魚所用的自來水(經氯氣消毒),需經日曬或放置一段時間后,再注入魚缸。其主要目的是( )
A. 提高水溫,有利于金魚生長
B. 利用紫外線殺滅水中的細菌
C. 增加水中氧氣的含量
D. 除去溶于水中Cl2,并促使次氯酸分解,以利于金魚存活
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L的恒容密閉容器中充入A(g)和B(g),發生反應A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ·mol-1,實驗內容和結果分別如表和圖所示,下列說法不正確的是
2C(g)+D(s) △H=a kJ·mol-1,實驗內容和結果分別如表和圖所示,下列說法不正確的是
實驗序號 | 溫度 | 起始物質的量 | 熱量變化 | |
A | B | |||
I | 600℃ | 1mol | 3mol | 96kJ |
II | 800℃ | 1.5mol | 0.5mol | —— |
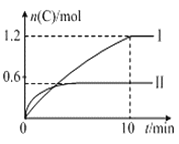
A. 實驗Ⅰ中,10 min內平均速率v(B)=0.03 mol·L-1·min-1
B. 上述方程式中a=160
C. 600 ℃時,該反應的平衡常數是1.5
D. 向實驗Ⅱ的平衡體系中再充入0.5 mol A和1.5 mol B,A的轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、E、F五種常見物質含有同一元素M,在一定條件下它們有如下轉化關系,Z是NO,下列推斷不合理的是:

A. X可能是一種氫化物
B. 若Y為單質,Y生成Z屬于化合反應
C. E可能是一種有色氣體
D. F中M元素的化合價可能為+5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com