
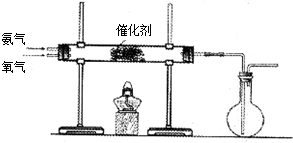
| ||
| ||
| ||
| ||


科目:高中化學 來源: 題型:
| 實驗操作 | 實驗現象 | 實驗結論 | |
| 猜想 | 在一支潔凈的試管中加入適量的上述淡黃色粉末,再加入足量的蒸餾水 | 猜想a、c不成立,猜想b成立. | |
| 探究 | ①用帶火星的木條伸入過氧化鈉與水反應的試管中 | 木條復燃 | 生成物有 |
| ②往①試管內的溶液中滴加 | 生成物有氫氧化鈉 |
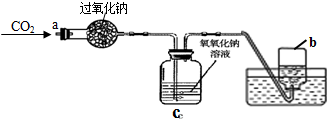
| 實驗操作 | 實驗現象 | 實驗結論 |
| ①將CO2從a口處通入裝置內,充分反應后,再把帶火星的木條放入收集滿氣體的集氣瓶b中 | 木條復燃 | CO2在常溫下能與過氧化鈉反應,該反應的化學方程式為: |
| ②取出充分反應后的固體生成物于試管中,往試管內滴加稀鹽酸,將生成的氣體通入澄清石灰水中 | 有氣泡產生;石灰水變渾濁 |
查看答案和解析>>
科目:高中化學 來源: 題型:

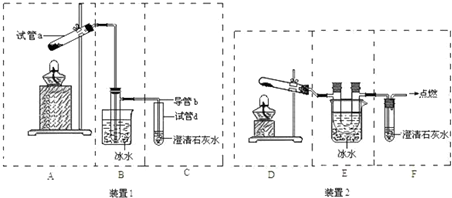
查看答案和解析>>
科目:高中化學 來源: 題型:
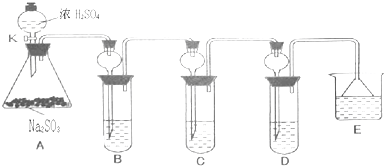
查看答案和解析>>
科目:高中化學 來源: 題型:
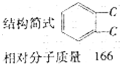 實驗室中某試劑瓶的標簽嚴重破損,只能隱約看到如圖所示部分:
實驗室中某試劑瓶的標簽嚴重破損,只能隱約看到如圖所示部分:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
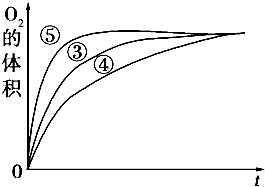 某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.
某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.| 分組實驗 | 催化劑 | |
| ① | 10mL 5% H2O2溶液 | 無 |
| ② | 10mL 2% H2O2溶液 | 無 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com