
【題目】下列離子方程式書寫正確的是( )
A.以石墨作電極電解AlCl3溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.Fe(OH)3與過量的HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.NaHSO4溶液與Ba(OH)2溶液混合:SO42-+Ba2+=BaSO4↓
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】某可逆反應aA+bB![]() cC在某溫度下的平衡常數為K(K≠1),反應熱為ΔH。保持溫度不變,將方程式的書寫作如下改變,則ΔH和K數值的相應變化為( )
cC在某溫度下的平衡常數為K(K≠1),反應熱為ΔH。保持溫度不變,將方程式的書寫作如下改變,則ΔH和K數值的相應變化為( )
A.寫成2aA+2bB![]() 2cC,ΔH值、K值均擴大了一倍
2cC,ΔH值、K值均擴大了一倍
B.寫成2aA+2bB![]() 2cC,ΔH值擴大了一倍,K值保持不變
2cC,ΔH值擴大了一倍,K值保持不變
C.寫成cC![]() aA+bB,ΔH值、K值變為原來的相反數
aA+bB,ΔH值、K值變為原來的相反數
D.寫成cC![]() aA+bB,ΔH值變為原來的相反數,K值變為原來的倒數
aA+bB,ΔH值變為原來的相反數,K值變為原來的倒數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.將純水加熱的過程中,Kw變大、pH變小
B.配制FeSO4溶液時,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼燒至恒重,最終得到FeCl3固體
D.向0.1mol/L氨水中加入少量水,溶液中![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置為鋰釩氧化物二次電池,其成本較低,且對環境無污染:V2O5+xLi![]() LixV2O5;在圖中用該電池電解含鎳酸性廢水可得到單質鎳。下列說法正確的是
LixV2O5;在圖中用該電池電解含鎳酸性廢水可得到單質鎳。下列說法正確的是
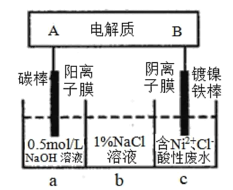
A.該電池充電時,B電極的電極反應式為:LixV2O5-xe-=V2O5+xLi+
B.鋰釩氧化物二次電池可以用LiCl水溶液作為電解液
C.電解過程中,b中NaCl溶液的物質的量濃度會增大
D.當鋰釩氧化物二次電池中有7gLi參與放電時,轉移電子數為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上設計將VOSO4中的K2SO4、SiO2雜質除去并回收得到V2O5的流程如下:
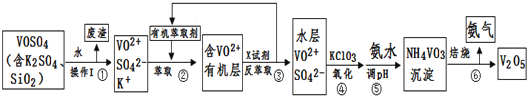
請回答下列問題:
(1)步驟①所得廢渣的成分是____________寫化學式),操作I的名稱______。
(2)步驟②、③的變化過程可簡化為(下式R表示VO2+,HA表示有機萃取劑):
R2(SO4)n(水層)+ 2nHA(有機層)![]() 2RAn(有機層) + nH2SO4 (水層)
2RAn(有機層) + nH2SO4 (水層)
②中萃取時必須加入適量堿,其原因是____________________________。
③中X試劑為___________________。
(3)⑤的離子方程式為________________________。
(4)25℃時,取樣進行試驗分析,得到釩沉淀率和溶液pH之間關系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
釩沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
結合上表,在實際生產中,⑤中加入氨水,調節溶液的最佳pH為__________;
若釩沉淀率為93.1%時不產生Fe(OH)3沉淀,則溶液中c(Fe3+)<_____________。
(已知:25℃時,Ksp[Fe(OH)3]=2.6×10-39)
(5)該工藝流程中,可以循環利用的物質有______________和_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20世紀80年代后,人們發現和證實了碳的另一類單質,它們是由一系列偶數個碳原子組成的分子,其中C60(足球烯,分子中含有30個雙鍵)最具代表性。下圖所示為n個C60連接而成的物質X。下列有關說法不正確的是

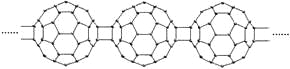
A.X難溶于水B.一定條件下X可與H2發生加成反應
C.X是碳的一種同素異形體D.X的摩爾質量為720n
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】針對下圖裝置的說法中正確的是( )

A. 溶液中pH明顯下降
B. 鐵片為正極,鍍鋅鐵片為負極
C. 鐵片的電極反應式:Fe-2e-=Fe2+
D. 電子由鋅經溶液流向鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】.甲胺鉛碘(CH3NH3PbI3)可用作全固態鈣鈦礦敏化太陽能電池的敏化劑,該物質可由甲胺(CH3NH2)、PbI2 及 HI 為原料來合成。請回答下列問題:
(1)制取甲胺的反應為 CH3OH(g)+NH3(g)==CH3NH2(g)+H2O(g),已知該反應中相關化學鍵的鍵能數據如下表所示:
共價鍵 | C-O | H-O | N-H | C-N |
鍵能/(kJ | 351 | 463 | 393 | 293 |
則該反應的△H=_____kJ·mol-1
(2)工業上利用水煤氣合成甲醇的反應為 CO(g)+2H2(g) ![]() CH3OH(g) △H<0。一定溫度下, 向體積為 2L 的密閉容器中加入 CO 和 H2,5min 末反應達到化學平衡狀態,測得各組分濃度如下表所示。
CH3OH(g) △H<0。一定溫度下, 向體積為 2L 的密閉容器中加入 CO 和 H2,5min 末反應達到化學平衡狀態,測得各組分濃度如下表所示。
物質 | CO | H2 | CH3OH |
濃度/(mol | 0.9 | 1.0 | 0.6 |
①0~5min 內,用 CO 表示的平均反應速率為_____。
②既能加快反應速率,又能提高氫氣轉化率的措施有_____(答一條即可)。
③能說明上述反應已達化學平衡狀態的是_____(填字母)。
A.v正 (CO)=2v逆 (H2)
B.混合氣體密度保持不變
C.反應容器內壓強保持不變
D.混合氣體的平均摩爾質量不變
(3)PbI2 可由 Pb3O4 和 HI 反應制備,反應的化學方程式為_____。
(4)常溫下 PbI2 飽和溶液中 c(I-)=2.0×10-3mol·L-1,則 Ksp(PbI2)=________;已知Ksp(PbS)=4.0×10-28,則反應 PbI2(s)+2-(aq) ![]() PbS(s)+2I-(aq)的平衡常數K=_______________________。
PbS(s)+2I-(aq)的平衡常數K=_______________________。
(5)HI 的分解反應曲線和液相法制備 HI 的反應曲線分別如圖 1 和圖 2 所示:
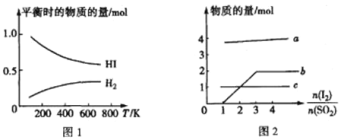
①反應 H2(g)+I2(g)![]() 2HI(g)的△H__________(填“>”或“<")0。
2HI(g)的△H__________(填“>”或“<")0。
②將 SO2 通入碘水中會發生反應:SO2+I2+2H2O==4H++SO42-+2I-,I2+I- ![]() I3-。圖 2 中曲線 b 所代表的微粒是_____(填微粒符號)。
I3-。圖 2 中曲線 b 所代表的微粒是_____(填微粒符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鋁在生產生活中有廣泛用途。
(1)鋁元素在元素周期表中位于______________。
(2)用化學方程式表示工業制備鋁單質______________。 鋁熱反應可用于焊接鋼軌,下圖為鋁熱反應的實驗裝置圖。
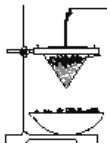
(3) 該鋁熱反應的化學方程式是______________。鋁熱反應的反應現象說明反應物的總能量___________生成物的總能量(填“<”、“>”或“=”)。
(4)鋁熱反應在工業上用于冶煉______________金屬(填編號)。
A. 強還原性 B. 難熔性 C. 易導電 D. 活潑
(5)反應結束后,從沙中取出生成的固體物質,有同學推測該固體是鐵鋁合金,他設計了如下實驗證明此 固體中含有金屬鋁:取少量固體于試管中,滴加______________,當觀察到______________現象時,證明固體中含有金屬鋁。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com