
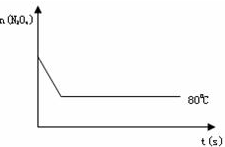
在80℃時,將0.20 mol的四氧化二氮氣體充入1 L已抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:

根據本題內容和表格中提供的數據填空(C1、C2、C3、A、B表示相應的濃度)請回答下列各小題:
(1)該反應的化學方程式為________;達到平衡時四氧化二氮的轉化率為________%,表中C2________C3________A(填“<”、“=”或“>”).
(2)20 s時,四氧化二氮的濃度C1=________mol·L-1,在0~20 s內四氧化二氮的平均反應速率為________.
(3)若在相同情況下最初向該容器充入的是二氧化氮氣體,要達到上述同樣的平衡狀態,二氧化氮的起始濃度是________mol·L-1.
科目:高中化學 來源: 題型:
 在80℃時,將0.40mol的N204氣體充入2L已經抽空的固定容積的密閉容器中,發生如下反應:N2O4?2NO2,隔一段時間對該容器內的物質進行分析,得到如下數據:
在80℃時,將0.40mol的N204氣體充入2L已經抽空的固定容積的密閉容器中,發生如下反應:N2O4?2NO2,隔一段時間對該容器內的物質進行分析,得到如下數據:| 時間(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 時間/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化學 來源: 題型:
 2NO2 (紅棕色),在80℃時,將0.80mol的N2O4氣體充入4L已經抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:
2NO2 (紅棕色),在80℃時,將0.80mol的N2O4氣體充入4L已經抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:| 時間(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 時間/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化學 來源:寧夏中衛市海原一中2011-2012學年高二第一學段考試化學試題 題型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com