
【題目】鐵及其化合物在日常生產生活中應用廣泛,研究鐵及其化合物的應用意義重大。
(1)所含鐵元素的物質只有還原性是___。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)當人體缺鐵時,往往需要吃補鐵保健品。人體能夠吸收的是+2價的鐵,但是+2價的鐵很容易被氧化。
①如何檢驗某固體補鐵劑中鐵元素已被氧化,寫出操作過程、現象及結論。答:___。
②服用維生素C,可使食物中的三價鐵離子轉化為二價鐵離子。由此可推知,維生素C具有___(填化學性質)。
(3)高鐵酸鉀(K2FeO4)是一種新型、高效、多功能綠色水處理劑。濕法制備高鐵酸鉀(K2FeO4)的反應體系中有六種微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。寫出并配平濕法制高鐵酸鉀的離子反應方程式:__Fe(OH)3+__ClO-+__=__FeO42-+__Cl-+___
(4)工業上用氯化鐵腐蝕銅箔、制造電路板。某工程師為了從使用過的腐蝕廢液中回收銅,并獲得氯化鐵晶體,準備采用下列步驟:
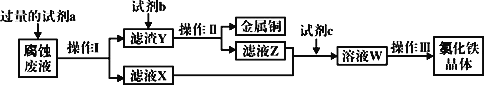
回答下列問題:
①試劑a是___,操作I用到的玻璃儀器有燒杯、玻璃棒和___。
②濾液X、Z中都有同一種溶質,它們轉化為溶液W的離子方程式為___。
③寫出FeCl3溶液與金屬銅發生反應的離子方程式:___。
【答案】A 研細后用水或鹽酸溶解,滴入KSCN溶液,若溶液變紅色,說明已被氧化 還原性 2 3 4OH- 2 3 5H2O 鐵(Fe) 漏斗 2Fe2++Cl2=2Fe3++2Cl- 2Fe3++Cu=2Fe2++Cu2+
【解析】
(1)處于最高價態時只有氧化性,處于最低價態時只有還原性,處于中間價態時既有氧化性又有還原性;
(2)①Fe3+能與KSCN溶液反應生成絡合物而導致溶液呈血紅色;
②Fe3+具有氧化性,能被還原性物質還原生成Fe2+;
(3)該反應中Fe元素化合價由+3價變為+6價,Cl元素化合價由+1價變為-1價,溶液呈堿性,則反應物中還含有OH-,根據元素守恒、原子守恒知,還生成H2O;
(4)腐蝕液中含有FeCl2、CuCl2,分離難溶性固體和溶液采用過濾方法,所以操作I為過濾;向腐蝕液中加入過量的試劑a,得到濾渣Y和濾液X,加入的a為Fe,濾渣Y為Cu、Fe,濾液X為FeCl2,向濾渣Y中加入試劑b為稀鹽酸,然后過濾得到Cu和濾液Z,Z中含有FeCl2和過量稀鹽酸,然后加入試劑c,應該加入氯水,將FeCl2氧化為FeCl3,最后將溶液W蒸發濃縮、冷卻結晶、過濾得到氯化鐵晶體。三價鐵具有氧化性,和銅發生氧化還原反應。
(1)處于最高價態時只有氧化性,處于最低價態時只有還原性,處于中間價態時既有氧化性又有還原性,
A. Fe處于最低價態,只有還原性,故A正確;
B.FeCl2 中Fe元素處于中間價態,既有氧化性又有還原性,故B錯誤;
C. FeCl3中Fe元素具有氧化性,故C錯誤;
D. Fe2O3中Fe元素具有氧化性,故D錯誤;
故答案選A;
(2)①Fe3+能與KSCN溶液反應生成絡合物而導致溶液呈血紅色,所以可以用KSCN溶液檢驗鐵離子,其檢驗方法為研細后用鹽酸溶解,滴入KSCN溶液,若溶液變紅色,說明已被氧化,
故答案為:研細后用鹽酸溶解,滴入KSCN溶液,若溶液變紅色,說明已被氧化;
②Fe3+具有氧化性,能被還原性物質還原生成Fe2+,服用維生素C,可使食物中的三價鐵離子轉化為二價鐵離子,說明維生素C能被鐵離子氧化,則維生素C具有還原性,
故答案為:還原性;
(3)該反應中Fe元素化合價由+3價變為+6價,Cl元素化合價由+1價變為1價,溶液呈堿性,則反應物中還含有OH,根據元素守恒、原子守恒知,還生成H2O,離子方程式為2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O,
故答案為:2;3;4OH;2;3;5H2O;
(4)腐蝕液中含有FeCl2、CuCl2,分離難溶性固體和溶液采用過濾方法,所以操作I為過濾;向腐蝕液中加入過量的試劑a,得到濾渣Y和濾液X,加入的a為Fe,濾渣Y為Cu、Fe,濾液X為FeCl2,向濾渣Y中加入試劑b為稀鹽酸,然后過濾得到Cu和濾液Z,Z中含有FeCl2和過量稀鹽酸,然后加入試劑c,應該加入氯水,將FeCl2氧化為FeCl3,最后將溶液W蒸發濃縮、冷卻結晶、過濾得到氯化鐵晶體;
①試劑a是Fe,操作I為過濾,用到的玻璃儀器有燒杯、玻璃棒和漏斗,
故答案為:Fe;漏斗;
②濾液X、Z中都有同一種溶質氯化亞鐵,它們轉化為溶液氯化鐵的離子方程式為2Fe2++Cl2═2Fe3++2Cl,
故答案為:2Fe2++Cl2═2Fe3++2Cl;
③FeCl3溶液與金屬銅發生氧化還原反應:2Fe3++Cu=2Fe2++Cu2+,
故答案為2Fe3++Cu=2Fe2++Cu2+;


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】某混合物漿液含Al(OH)3、MnO2和少量Na2CrO4。考慮到膠體的吸附作用使Na2CrO4不易完全被水浸出,某研究小組利用設計的電解分離裝置(見圖2),使漿液分離成固體混合物和含鉻元素溶液,并回收利用。回答Ⅰ和Ⅱ中的問題。

Ⅰ.固體混合物的分離和利用(流程圖中的部分分離操作和反應條件未標明)
(1)反應①所加試劑NaOH的電子式為_________,B→C的反應條件為__________,C→Al的制備方法稱為______________。
(2)該小組探究反應②發生的條件。D與濃鹽酸混合,不加熱,無變化;加熱有Cl2生成,當反應停止后,固體有剩余,此時滴加硫酸,又產生Cl2。由此判斷影響該反應有效進行的因素有(填序號)___________。
a.溫度 b.Cl-的濃度 c.溶液的酸度
(3)0.1 mol Cl2與焦炭、TiO2完全反應,生成一種還原性氣體和一種易水解成TiO2·xH2O的液態化合物,放熱4.28 kJ,該反應的熱化學方程式為__________。
Ⅱ.含鉻元素溶液的分離和利用
(4)用惰性電極電解時,CrO42-能從漿液中分離出來的原因是__________,分離后含鉻元素的粒子是_________;陰極室生成的物質為___________(寫化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,將3 mol A氣體和1 mol B氣體混合于固定容積為2 L的密閉容器中,發生反應:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末該反應達到平衡,生成D的物質的量隨時間的變化情況如圖所示。下列判斷正確的是( )
C(g)+2D(s)。2 min末該反應達到平衡,生成D的物質的量隨時間的變化情況如圖所示。下列判斷正確的是( )
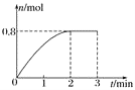
A. 若混合氣體的密度不再改變時,該反應不一定達到平衡狀態
B. 2 min后,加壓會使正反應速率加快,逆反應速率變慢
C. 反應過程中A和B的轉化率之比為3∶1
D. 開始到平衡,用A表示的化學反應速率為0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的鹽酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用過量的CO在高溫下還原相同質量的原混合物,固體減少的質量為
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗原理或操作正確的是
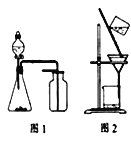
A.用廣泛pH試紙測得0.1 molL-1 NH4Cl溶液的pH=5.2
B.選擇合適的試劑,用圖1裝置可分別制取和收集少量CO2、NO
C.除去石英(主要成分SiO2)中少量碳酸鈣:用稀鹽酸溶解后用圖2裝置過濾
D.洗滌沉淀時(見圖2),向漏斗中加適量水,攪拌并濾干
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氨的敘述中不正確的是( )
A. 氨分子中氮元素的化合價只能升高,氨具有還原性
B. 氨的催化氧化反應的化學方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反應中若氧氣過量則有紅棕色氣體生成
D. 氨的催化氧化屬于人工氮的固定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水四氯化錫(SnCl4)常用作有機合成的氯化催化劑。實驗室可用熔融的錫(熔點232℃)與Cl2反應制備SnCl4,裝置如下圖所示。
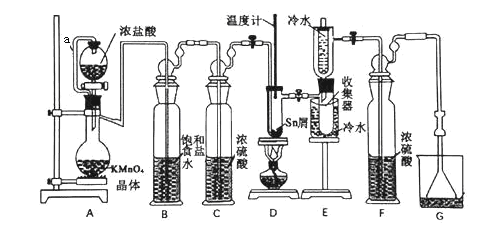
已知:①SnCl2、SnCl4有關物理性質如下表
物質 | 顏色、狀態 | 熔點/℃ | 沸點/℃ |
SnCl2 | 無色晶體 | 246 | 652 |
SnCl4 | 無色液體 | -33 | 114 |
②SnCl4遇水極易水解生成SnO2·xH2O。
回答下列問題:
(1)導管a的作用是__________,裝置A中發生反應的離子方程式為_____________ 。
(2)當觀察到裝置F液面上方出現______ 現象時才開始點燃酒精燈,待錫熔化后適當增大氯氣流量,繼續加熱。此時繼續加熱的目的有兩點:加快氯氣與錫反應和_________。
(3)若上述裝置中缺少裝置C(其它均相同),則D處具支試管中發生的主要副反應化學方程式為_______________________________。
(4)Cl2和Sn的反應產物有SnCl4和SnCl2,為了防止產品中帶入過多的SnCl2,裝置D可改為油浴加熱來控制溫度,該溫度范圍是________。
(5)制得的SnCl4產品中常含有SnCl2,可用如下方法測定產品純度:先準確稱量7.60g產品于錐形瓶中,再加過量的FeCl3溶液,發生反應:SnCl2+2FeCl3===SnCl4+2FeCl2,再用0.1000 mol·L—1 K2Cr2O7標準溶液滴定生成的Fe2+,此時還原產物為Cr3+,消耗標準溶液 20.00 mL,則SnCl4產品的純度為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉常用作漂白劑、殺菌消毒劑,能與水和二氧化碳等物質發生反應,保存不當容易變質。某興趣小組以過氧化鈉為對象進行如下探究:
探究一: “干燥的CO2不能與Na2O2反應”和“CO2在有水存在時才能與Na2O2反應”,設計如下實驗裝置:
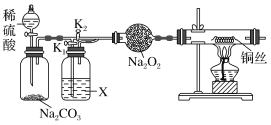
(1)連接裝置,檢查氣密性。在干燥管中裝入Na2O2后,打開活塞加入稀硫酸,生成CO2。打開K1,關閉K2,一段時間后再加熱銅絲。其中,X中應加入試劑_____________(填名稱)。先通一段時間CO2的目的是____________________________________,實驗觀察到銅絲未變化,則得出結論“干燥的CO2不能與Na2O2反應”。
(2)若打開K2,關閉K1,出現_____________________________現象,可證明“有水時CO2與Na2O2反應”產生了O2。
探究二:Na2O2是否已經變質并粗略測定該樣品中Na2O2的質量分數
(3)乙同學為粗略測定該樣品中Na2O2的質量分數,稱取m g樣品,設計如下裝置進行實驗:
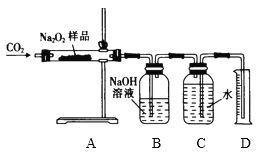
實驗開始后,A中發生反應的化學方程式為:______________________________;利用裝置B除去混合氣體未反應的CO2;調整裝置C、D內液面高度相同,讀出量筒D中水的體積,并將其折算成氧氣的質量為n g。則該樣品中Na2O2的質量分數為:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國著名化學家申泮文教授對硼烷化學的研究開啟了無機化學的新篇章;硼族元素及其化合物應用廣泛。回答下列問題:
(1)基態B原子的價電子軌道表達式為________,B原子核外電子有_____個不同的能級。
(2)硼、鋁同主族,晶體硼的熔點為2300℃,金屬鋁的熔點為660.3℃,試從晶體結構解釋其原因:_________________________________________________。
(3)實驗測得AlCl3的蒸氣是締合的雙分子(Al2Cl6),它的結構和球棍模型如圖:
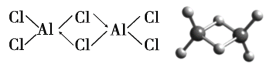
已知在Al2Cl6分子中正負電荷中心重合,則Al2Cl6屬于______分子(填“極性”或“非極性”),其中Al原子的軌道雜化類型是_________。
(4)氨硼烷(NH3BH3)是一種高性能新型儲氫材料,分子中存在配位鍵,提供孤電子對的成鍵原子是________(填元素符號),寫出一種與氨硼烷互為等電子體的分子________(填化學式)。
(5)常溫常壓下硼酸(H3BO3)晶體結構為層狀,其二維平面結構如圖1所示。試解釋硼酸在冷水中的溶解度小而加熱時溶解度增大的原因_________________________________________。
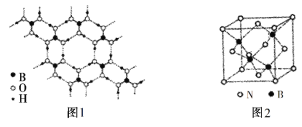
(6)氮化硼(BN)晶體是一種特殊的耐磨和切削材料,其晶胞結構與金剛石相似,如圖2所示。
①氮化硼晶體中與氮原子直接連接的硼原子構成的幾何形狀為________。
②已知立方氮化硼晶體中晶胞參數為a nm,阿伏加德羅常數值為NA,則該晶體的密度表達式為_________gcm3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com