
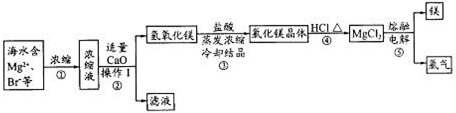
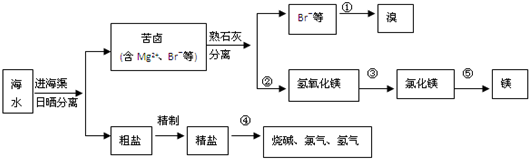
海水資源的開發和利用是當前科學研究的一項重要任務。下圖是實驗室模擬鎂開發的流程圖:
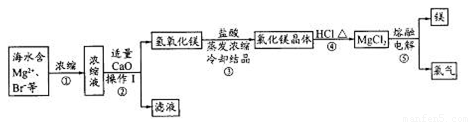
根據上述流程圖,回答下列問題:
(1)操作I的名稱是 。
(2)步驟中②反應的化學方程式為 。
(3)步驟④中加熱時通入HCl氣流的作用是 。
(4)步驟⑤的離子反應方程式為 。
(5)有人提出步驟⑤的副產物可在流程中再利用以提高海水的綜合利用率。若A為上述流程中的某組分,則A、B分別為 。
(1)過濾(1分)
(2)CaO+H2O=Ca(OH)2(1分) MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) (1分)
(3)增大HCl濃度抑制MgCl2的水解(1分)
(4)Mg2++2Cl- Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
(5)濾液(或濃縮液) Br2(2分,各1分)
【解析】
試題分析:
海水中主要有Na+,Cl-,Mg2+,Br-, SO42-等離子,蒸發濃縮后取濃縮液加CaO后會產生Mg(OH)2↓,進行過濾,濾液中當然含有Na+,Cl-,Br-, SO42-等離子。取所得的Mg(OH)2加HCl后進行濃縮結晶得到MgCl2晶體。再在HCl氛圍中加熱使其失去結晶水,得到MgCl2后,在進行電解得到Mg和Cl2。
(1)將固體和液體分開采用過濾(2)步驟中②反應的化學方程式為CaO+H2O=Ca(OH)2
MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(3)步驟④中加熱時通入HCl增大HCl濃度,在HCl氛圍中,抑制MgCl2的水解,不能直接加熱,否則MgCl2晶體會發生水解得到Mg(OH)2(4)步驟⑤的離子反應方程式為Mg2++2Cl- Mg+Cl2,電解方程式,在熔融狀態下MgCl2會電離出離子,所以要拆成離子形式。(5)上述流程中除了Mg,還能與Cl2反應的只有Br-,存在于溶液中,通過Cl2置換,可以回收利用Br2
Mg+Cl2,電解方程式,在熔融狀態下MgCl2會電離出離子,所以要拆成離子形式。(5)上述流程中除了Mg,還能與Cl2反應的只有Br-,存在于溶液中,通過Cl2置換,可以回收利用Br2
考點:物質的分離與提純(水解,離子方程式書寫,實驗操作等)


 世紀百通主體課堂小學課時同步達標系列答案
世紀百通主體課堂小學課時同步達標系列答案科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com