
 我國科學家發明的一種可控鋰水電池,可作為魚雷和潛艇的儲備電源.其工作原理如圖所示.下列有關說法不正確的是( )
我國科學家發明的一種可控鋰水電池,可作為魚雷和潛艇的儲備電源.其工作原理如圖所示.下列有關說法不正確的是( )| A. | 電池工作時,電子的流向:鋰電極→導線→碳電極 | |
| B. | 水既是氧化劑又是溶劑,有機電解質可用水溶液代替 | |
| C. | 電池總反應為2Li+2H2O=2LiOH+H2 | |
| D. | 該裝置不僅可提供電能,還可得到清潔燃料氫氣 |
分析 因鋰與水反應,則形成原電池時鋰為負極,碳為正極,且負極不能與水接觸,負極反應為Li-e-=Li+,正極反應為2H2O+2e-=H2↑+2OH-,結合電極方程式解答該題.
解答 解:A.鋰為負極,為原電池的負極,碳為正極,則電子的流向:鋰電極→導線→碳電極,故A正確;
B.由于金屬Li可以和水之間反應生成氫氧化鋰和氫氣,但是和有機電解質不反應,所以有機電解質不可用水溶液代替,故B錯誤;
C.負極反應為Li-e-=Li+,正極反應為2H2O+2e-=H2↑+2OH-,電池總反應為2Li+2H2O=2LiOH+H2,故C正確;
D.反應可提供電能,且生成氫氣,可用作清潔燃料,故D正確.
故選B.
點評 本題考查新型電池,為高頻考點,側重于學生的分析能力的考查,題目難度不大,解答本題的關鍵是根據物質的性質判斷電極反應,并能書寫有關反應的離子方程式.


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | 能自發進行的反應一定能迅速發生 | |
| B. | 反應NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自發進行,是因為體系有自發地向混亂度增大的方向轉變的傾向 | |
| C. | 因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨作為判斷反應能否自發進行的判據 | |
| D. | 在其他外界條件不變的情況下,使用催化劑,可以改變化學反應進行的方向 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 金屬鈉加入稀硫酸中:Na+2H+═Na++H2↑ | |
| C. | 明礬溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 向含有稀鹽酸的氯化亞鐵溶液中通入氧氣:4Fe2++O2+4H+═4 Fe3++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 加3%Na2S2O3/mL | 加1:5的H2SO4/滴 | 溫度/℃ | |
| A | 5 | 25 | 25 |
| B | 5 | 15 | 35 |
| C | 5 | 25 | 45 |
| D | 5 | 15 | 45 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
硝酸銨 | 過氧化鈉 高錳酸鉀 氯酸鉀 |
鈉 鈣 過氧化氫 | 氧化鈉 |
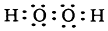
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
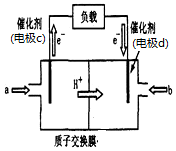 火力發電廠釋放出的大量NONOx、SO2、CO2會對環境造成污染.對燃煤廢氣進行脫硝、脫硫和脫碳等處理,可實現節能減排、廢物利用等目的.
火力發電廠釋放出的大量NONOx、SO2、CO2會對環境造成污染.對燃煤廢氣進行脫硝、脫硫和脫碳等處理,可實現節能減排、廢物利用等目的.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 本月4日,谷歌公司宣布:以60勝O負1平的戰績橫掃眾多圍棋高手的神秘棋手“Master”乃是其人工智能產品AlpbaGo的升級版,人工智能再次成為熱門話題.其中,高純度硅是一種重要的基礎材料.以下是工業上制取純硅的一種方法:
本月4日,谷歌公司宣布:以60勝O負1平的戰績橫掃眾多圍棋高手的神秘棋手“Master”乃是其人工智能產品AlpbaGo的升級版,人工智能再次成為熱門話題.其中,高純度硅是一種重要的基礎材料.以下是工業上制取純硅的一種方法:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將NaCl固體置于托盤天平右盤稱量:左盤砝碼(8g)和游碼(0.6g)讀數的和為8.6g | |
| B. | 容量瓶上標有刻度線、溫度和濃度,使用前要事先檢查是否漏水 | |
| C. | 配制一定物質的量濃度的溶液用到的主要儀器有:托盤天平、量筒、燒杯、玻璃棒、容量瓶、膠頭滴管 | |
| D. | 配制1L0.2mol/L的H2SO4溶液,定容時仰視刻度線操作,則配出濃度偏高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應過程中的能量變化除了熱能外,還可以是光能、電能等 | |
| B. | 放熱反應的△H<0 | |
| C. | 需要加熱才能發生反應一定是吸熱反應 | |
| D. | 反應物的總能量低于生成物的總能量時,發生吸熱反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com