
在一個不導熱的密閉反應器中,只發生兩個反應:
a(g)+b(g) 2c(g);△H1<0
2c(g);△H1<0
x(g)+3y(g) 2z(g);△H2>0
2z(g);△H2>0
進行相關操作且達到平衡后(忽略體積改變所作的功),下列敘述錯誤的是
A.等壓時,通入惰性氣體,c的物質的量不變
B.等壓時,通入z氣體,反應器中溫度升高
C.等容時,通入惰性氣體,各反應速率不變
D.等容時,通入z氣體,y的物質的量濃度增大
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年江蘇省高一上期中化學卷(解析版) 題型:選擇題
氧化還原反應與四種基本反應類型的關系如下圖所示,則下列化學反應屬于丙區域的是( )

A.Cl2+2KBr=Br2+2KCl
B.2NaHCO3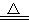 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.3Mg+N2 Mg3N2
Mg3N2
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江雙鴨山一中高二上期中化學卷(解析版) 題型:選擇題
對于反應:4CO(g)+2NO2(g)= 4CO2(g)+N2(g) △H=-1200 kJ· mol-1,溫度不同 (T2>T1)其他條件相同時,下列圖像正確的是
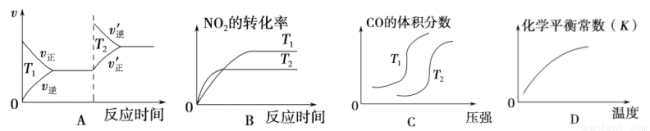
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江大慶一中高二上11月月考化學卷(解析版) 題型:實驗題
高鐵酸鹽在能源、環保等方面有著廣泛的用途。濕法、干法制備高鐵酸鹽的原理如下表所示。
濕法 | 強堿性介質中,Fe(NO3)3與NaClO反應生成紫紅色高鐵酸鹽溶液 |
干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鹽和KNO2等產物 |
(1)工業上用濕法制備高鐵酸鉀(K2FeO4)的流程如下圖所示 :
:

①洗滌粗品時選用異丙醇而不用水的理由是: 。
②反應Ⅱ的離子方程式為 。
③高鐵酸鉀在水中技能消毒殺菌,又能凈水,是一種理想的水處理劑,它能消毒殺菌是因為 ,它能凈水的原因是因為 。
④已知25℃時Fe(OH)3的Ksp = 4.0×10-38,反應II后的溶液c(Fe3+)=4.0×10-5mol/L,則需要調整到 時,開始生成Fe(OH)3(不考慮溶液體積的變化)。
(2)由流程圖可見,濕法制備高鐵酸鉀時,需先制得高鐵酸鈉,然后再向高鐵酸鈉中加入飽和KOH溶液,即可析出高鐵酸鉀。
①加入飽和KOH溶液的目的是 。
②由以上信息可知:高鐵酸鉀的溶解度比高鐵酸鈉 (填“大”或“小”)。
(3)干法制備K2FeO4的反應中氧化劑與還原劑的物質的量之比為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江大慶一中高二上11月月考化學卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中一定能大量共存的是
A.0.1mol/L FeCl3溶液:K+、NH4+、SCN-、NO3-
B.0.1mol/LCu(NO3)2溶液:Na+、Mg2+、Cl-、SO42-
C.0.5mol/L AlCl3溶液:K+、Na+、S2-、SO42-
D.由水電離產生的c(H+)=10-13 mol·L-1的溶液:K +、Na+、HCO3-、Cl-
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江大慶一中高二上11月月考化學卷(解析版) 題型:選擇題
某溫度下在密閉容器中發生如下反應:2M(g)+N(g)  2E(g)若開始時只充入2 mol E(g),達平衡時,混合氣體的壓強比起始時增大了20%。若開始時只充入2 mol M和1 mol N的混合氣體,達平衡時M的轉化率為
2E(g)若開始時只充入2 mol E(g),達平衡時,混合氣體的壓強比起始時增大了20%。若開始時只充入2 mol M和1 mol N的混合氣體,達平衡時M的轉化率為
A.20% B.40% C.60% D.80%
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上期中化學試卷(解析版) 題型:實驗題
實驗室配制480Ml0.1mol/LNa2CO3溶液,請回答下列問題:
(1)配制480Ml0.1mol/LNa2CO3溶液時,需要Na2CO3固體的質量為________g。
(2)配制過程中所需的儀器除藥匙、天平、燒杯、量筒、玻璃棒、膠頭滴管外,還需要________儀器。若在稱量樣品時,藥品放在天平右盤上,砝碼放在天平左盤上,1g以下用游碼,天平平衡時,則實際稱量的十水合碳酸鈉質量________(填符號 A偏高 B偏低 C不變)
(3)配制時,其正確的操作順序是_______(天字母);
A、用30mL蒸餾水洗滌燒杯和玻璃棒各2-3次,洗滌液均注入容量瓶中,震蕩
B、用托盤天平準確稱量所需的Na2CO3的質量,放入燒杯中,再加入少量蒸餾水(約30mL),用玻璃棒慢慢攪動,使其完全溶解
C、將已冷卻至室溫的Na2CO3溶液沿玻璃棒注入一定規格的容量瓶中
D、將容量瓶蓋緊,震蕩,搖勻
E、改用膠頭滴管滴加蒸餾水,使溶液凹液面最低點恰好與刻度線相切
F、繼續往容量瓶內加入蒸餾水,直到液面距刻度線1~2㎝處
(4)若出現以下情況,對所配溶液濃度將有何影響(填“偏高”、“偏低”或“無影響”)?
①沒有進行A操作____________。
②家蒸餾水時不慎超過了刻度線____________。
③定容時俯視刻度線____________。
④溶液未恢復至室溫就注入容量瓶____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上期中化學試卷(解析版) 題型:選擇題
下列配制的溶液濃度偏高的是
A.配制鹽酸溶液,用量筒量取鹽酸時俯視刻度線
B.配制鹽酸溶液定容時,仰視容量瓶
C.稱量40gNaOH配制0.20mol/LNaOH溶液500mL時,砝碼錯放左盤
D.配制NaOH溶液時,溶液未經冷卻即注入容量瓶并定容至刻度線
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高二上11月月考化學卷(解析版) 題型:選擇題
下列固體物質溶液水,再將其溶液加熱,蒸發結晶、再灼燒,能得到化學組成與原固體物質相同的是①膽礬 ②氯化鋁 ③硫酸鋁 ④NaHCO3 ⑤氯化銅
A.③④ B.①③④ C.①②③④ D.全部
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com