
 現將一定量的銅片加入到100mL稀硫酸和硫酸鐵的混合溶液中,銅片完全溶解(不考慮鹽的水解及溶液體積的變化).
現將一定量的銅片加入到100mL稀硫酸和硫酸鐵的混合溶液中,銅片完全溶解(不考慮鹽的水解及溶液體積的變化).分析 (1)銅和鐵離子反應生成亞鐵離子和銅離子;
(2)根據原子守恒計算銅的質量;根據電荷守恒計算硫酸根離子濃度;
(3)若欲在如圖所示的裝置中發生(1)中的反應,則銅電極是負極,不如銅活潑的金屬或導電的非金屬作正極,負極上失電子發生氧化反應,正極上得電子發生還原反應.
解答 解:(1)銅和鐵離子反應生成亞鐵離子和銅離子,離子反應方程式為:Cu+2Fe3+═Cu2++2Fe2+,故答案為:Cu+2Fe3+═Cu2++2Fe2+;
(2)若銅完全溶解時,溶液中的Fe3+、Cu2+、H+三種離子的物質的量濃度相等,且測得溶液的pH=1,則c(H+)=c(Cu2+)=0.1mol/L,
反應后溶液中的陽離子為:Fe3+、Fe2+、Cu2+、H+,而Cu+2Fe3+═Cu2++2Fe2+,可見Fe2+的物質的量濃度為Cu2+的兩倍,依據溶液中的電荷守恒規律,故0.1mol/L×3+0.2mol/L×2+0.1mol/L×2+0.1mol/L×1=c(SO42-)×2,解得c(SO42-)=0.5mol/L;
故答案為:0.5;
(3)若欲在如圖所示的裝置中發生(1)中的反應,則銅電極是負極,不如銅活潑的金屬或導電的非金屬作正極,所以X電極是負極,
負極上電極反應式為:Cu-2e-═Cu2+,碳(石墨、金、鉑、銀)作正極,
正極上鐵離子得電子發生還原反應,電極反應式為:2Fe3++2e-═2Fe2+,
故答案為:負極;Cu-2e-═Cu2+;碳(石墨、金、鉑、銀);2Fe3++2e-═2Fe2+.
點評 本題考查原電池原理、物質的量的有關計算等知識點,為高頻考點,根據原電池的構成條件、電極反應及原子守恒、電荷守恒來分析解答即可,難度不大.


 輕巧奪冠周測月考直通中考系列答案
輕巧奪冠周測月考直通中考系列答案科目:高中化學 來源: 題型:選擇題
| A. | 酸:CH3COOH、H2SO3、NaHCO3、HF | B. | 堿:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2 | ||
| C. | 鹽:AgCl、BaSO4、NaH2PO4、Mg(NO3)2 | D. | 酸性氧化物:CO、CO2、SO2 SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
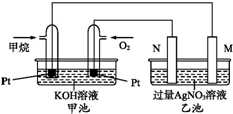 如圖是一個甲烷燃料電池工作時的示意圖.M、N兩電極的質量相同,其中一個為銀電極一個為鐵電極.
如圖是一個甲烷燃料電池工作時的示意圖.M、N兩電極的質量相同,其中一個為銀電極一個為鐵電極.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E五種物質,且A、B、C、D的焰色反應均為黃色,它們的關系如下圖所示,已知E為氣體單質,能使帶火星的木條復燃.
已知A、B、C、D、E五種物質,且A、B、C、D的焰色反應均為黃色,它們的關系如下圖所示,已知E為氣體單質,能使帶火星的木條復燃.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 外觀 | 在空氣中加熱時的現象 | 產物水溶液的酸堿性 |
| X | 黑色粉未 | 燃燒時呈熾紅色并發出火花,放出無色氣體G | 微弱酸性 |
| Y | 淡黃色晶體 | 首先熔化,然后燃燒,火焰為淺藍色,放出有刺激性氣味的氣體 | 弱酸性 |
| Z | 銀白色固體 | 燃燒,產生黃色火焰,生成淺黃色固體F | 強堿性 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
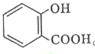 的名稱為:2-羥基苯甲酸;在核磁共振氫譜中會出現6組峰;寫出其與KHCO3溶液反應的化學方程式:
的名稱為:2-羥基苯甲酸;在核磁共振氫譜中會出現6組峰;寫出其與KHCO3溶液反應的化學方程式: +KHCO3→
+KHCO3→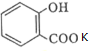 +CO2↑+H2O.
+CO2↑+H2O. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.01×105Pa,20℃時48g O3含有的原子數為3NA | |
| B. | 1molNa2O2晶體中陰離子數為2 NA | |
| C. | 標準狀況下,相同體積的O2、HCl、H2O含有的分子數相同 | |
| D. | 等質量鈉,在足量氧氣中加熱充分反應比在足量氧氣(常溫)中充分反應失去的電子多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將鐵粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 將磁性氧化鐵溶于鹽酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 將氯化亞鐵溶液和氯氣反應:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 將銅屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com