
氨基甲酸銨(NH2COONH4)是一種白色固體,易分解、易水解,
 可用做肥料、滅火劑、洗滌劑等。某化學興趣小組模擬工業原理制備氨基甲酸銨,反應的化學方程式如下:
可用做肥料、滅火劑、洗滌劑等。某化學興趣小組模擬工業原理制備氨基甲酸銨,反應的化學方程式如下:
2 NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右圖裝置制取氨氣,你所選擇的試劑是 。
(2)制備氨基甲酸銨的裝置如下圖所示,把氨氣和二氧化碳通入四氯化碳中,不斷攪拌混合,生成的氨基甲酸銨小晶體懸浮在四氯化碳中。當懸浮物較多時,停止制備。
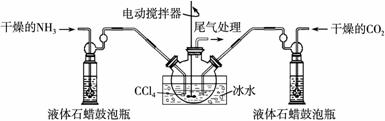
注:四氯化碳與液體石蠟均為惰性介質。
①發生器用冰水冷卻的原因是 。液體石蠟鼓泡瓶的作用是 。
②從反應后的混合物中分離出產品的實驗方法是 (填寫操作名稱)。為了得到干燥產品,應采取的方法是 (填寫選項序號)。
a. 常壓加熱烘干 b. 高壓加熱烘干 c. 真空40 ℃以下烘干
③尾氣處理裝置如右圖所示。雙通玻璃管的作用: ;
 濃硫酸的作用: 、 。
濃硫酸的作用: 、 。
(3)取因部分變質而混有碳酸氫銨的氨基甲酸銨樣品1.173 0 g,
用足量石灰水充分處理后,使碳元素完全轉化為碳酸鈣,過
濾、洗滌、干燥,測得質量為1.500 g。則樣品中氨基甲酸
銨的物質的量分數為 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]
 名題金卷系列答案
名題金卷系列答案科目:高中化學 來源: 題型:閱讀理解
 (2011?浙江)某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定.
(2011?浙江)某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定.| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:
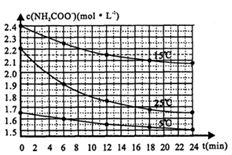 某研究小組在實驗室用三份不同初始濃度的氨基甲酸銨(NH2COONH4)溶液在不同溫度下進行水解實驗:NH2COONH4+2H2O?NH4CO3+NH3?H2O,測得c(NH2COO-)與反應時間的關系如圖所示.據圖判斷下列說法正確的是( )
某研究小組在實驗室用三份不同初始濃度的氨基甲酸銨(NH2COONH4)溶液在不同溫度下進行水解實驗:NH2COONH4+2H2O?NH4CO3+NH3?H2O,測得c(NH2COO-)與反應時間的關系如圖所示.據圖判斷下列說法正確的是( )查看答案和解析>>
科目:高中化學 來源:2012屆江西省南昌三中高三第三次月考化學試卷(帶解析) 題型:填空題
某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定。
(1)將一定量純凈的氨基甲酸銨置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s)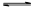 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
實驗測得不同溫度下的平衡數據列于下表:
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 B.密閉容器中總壓強不變
B.密閉容器中總壓強不變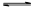 NH4HCO3+NH3·H2O。該研究小組分別用三份不同初始濃度的氨基甲酸銨溶液測定水解反應速率,得到c(NH2COO-)隨時間變化趨勢如圖所示。
NH4HCO3+NH3·H2O。該研究小組分別用三份不同初始濃度的氨基甲酸銨溶液測定水解反應速率,得到c(NH2COO-)隨時間變化趨勢如圖所示。
查看答案和解析>>
科目:高中化學 來源:2014屆吉林省長春市高一下學期期末考試化學試卷(解析版) 題型:實驗題
(10分)
I.(4分)某溫度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x與y的關系如圖所示:

(1)該溫度下,中性溶液的pH= 。
(2)該溫度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定。
(1)將一定量純凈的氨基甲酸銨置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。實驗測得不同溫度下的平衡數據列于下表:
2NH3(g)+CO2(g)。實驗測得不同溫度下的平衡數據列于下表:
|
溫度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡總壓強(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡氣體總濃度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判斷該分解反應已經達到化學平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密閉容器中總壓強不變
C.密閉容器中混合氣體的密度不變 D.密閉容器中氨氣的體積分數不變
②根據表中數據,計算25.0℃時的分解平衡常數為 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。該研究小組分別用三份不同初始濃度的氨基甲酸銨溶液測定水解反應速率,得到c(NH2COO-)隨時間變化趨勢如圖所示。
NH4HCO3+NH3·H2O。該研究小組分別用三份不同初始濃度的氨基甲酸銨溶液測定水解反應速率,得到c(NH2COO-)隨時間變化趨勢如圖所示。

③計算25℃時,0~6min氨基甲酸銨水解反應的平均速率為 。
④根據圖中信息,如何說明水解反應的平均速率隨溫度升高而增大:
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com