
| A. | 穩定性:Na2CO3>NaHCO3 | B. | 熔點:生鐵>純鐵 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
分析 A.碳酸鈉加熱不易分解;
B.生鐵是合金,合金的熔點一般小于各組分的熔點;
C.次氯酸為弱酸,酸性比碳酸還弱;
D.氧化還原反應中,氧化劑的氧化性大于氧化產物的氧化性.
解答 解:A.因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,而碳酸鈉加熱不分解,故A正確;
B.生鐵是合金,熔點小于純鐵的熔點,故熔點為純鐵>生鐵,故B錯誤;
C.次氯酸為弱酸,酸性比碳酸還弱,通過漂白粉的漂白原理可以證明,故C正確;
D.反應2Fe3++Cu=2Fe2++Cu2+中,氧化劑Fe3+的氧化性大于氧化產物Cu2+的氧化性,故D正確,故選B.
點評 本題主要考查的是物質穩定性比較、氧化性強弱判斷以及酸性強弱比較等,綜合性較強,但是難度不大.


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:多選題
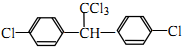 .下列有關DDT的說法正確的是( )
.下列有關DDT的說法正確的是( )| A. | 它屬于芳香烴 | B. | 分子中最多有23個原子共平面 | ||
| C. | 分子式為C14H9Cl5 | D. | 能發生水解反應和消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
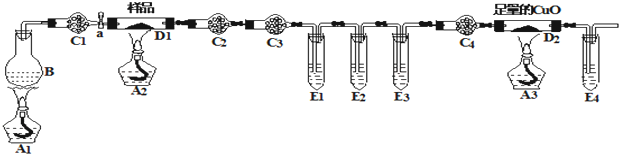
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 加入的物質 | 結論 | |
| A | 100mL H2O | 由水電離出的c(H+)•c(OH-)不變 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反應結束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固體 | 反應結束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
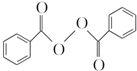 )過去常用作面粉增白劑,但目前已被禁用.合成過氧化苯甲酰的流程圖如圖:
)過去常用作面粉增白劑,但目前已被禁用.合成過氧化苯甲酰的流程圖如圖: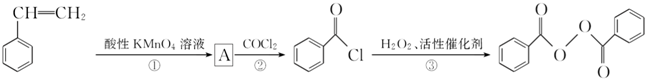
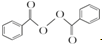 +2H2O→2
+2H2O→2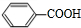 +H2O2;
+H2O2;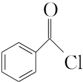 )能與水反應生成苯甲酸,同樣也能與乙醇反應,寫出其與乙醇反應生成的有機產物的名稱苯甲酸乙酯;
)能與水反應生成苯甲酸,同樣也能與乙醇反應,寫出其與乙醇反應生成的有機產物的名稱苯甲酸乙酯;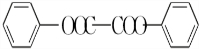 (或
(或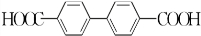 或
或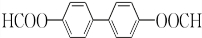 .;
.;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去SO2中的少量HCl:通入飽和NaHSO3溶液的洗氣瓶,干燥后收集氣體 | |
| B. | FeCl2溶液中混有FeCl3:加入過量鐵粉充分反應后過濾 | |
| C. | Na2CO3固體中混有少量NaHCO3:加入適量NaOH溶液 | |
| D. | 除去SiO2中的少量Al2O3:加入適量稀硫酸充分反應后過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
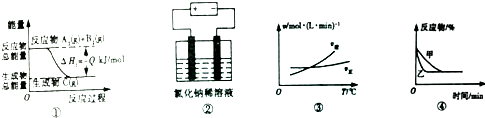
| A. | 圖①表示可逆反應A2(g)+B2(g)?C(g)的△H1大于0 | |
| B. | 圖②是電解氯化鈉稀溶液的電解池,其中陰、陽極產生氣體的體積之比一定為1:1 | |
| C. | 圖③表示可逆反應A2(g)+3B2(g)?2AB3(g)的△H小于0 | |
| D. | 圖④表示壓強對可逆反應2A(g)+2B(g)?3C(g)+D(s)的影響,乙曲線對應的壓強大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應是放熱還是吸熱必須看生成物和反應物所具有的總能量的相對大小 | |
| B. | 綠色植物進行光合作用時,將太陽能轉化為化學能儲存起來 | |
| C. | 吸熱反應都要加熱才能進行 | |
| D. | 物質的化學能可以在一定條件下轉化為熱能、電能為人類所利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | n(Na+)+n(H+)=n(HCO3-)+n(CO32-)+n(OH-) | |
| B. | 通入CO2,平衡向正反應方向移動 | |
| C. | 加入少量的NaOH固體,平衡向逆反應方向移動,溶液pH減小 | |
| D. | 稀釋溶液,Na2CO3水解程度增大,水解平衡常數增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com