
分析 (1)寫出正極電極反應式,用總反應式減去正極反應式即為負極反應式;
(2)先出現紅色,則在陰極上放出氫氣,氫氧根濃度增大,則其極與電源負極相連,為陰極,電極反應式為:2H2O+2e-═H2↑+2OH-;
(3)強酸與強堿反應,可用酚酞作指示劑,滴定前,酚酞遇堿無色,滴定后若變紅色,停止滴定;根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$,判斷不當操作對V(標準)影響,從而判斷對濃度的影響;
(4)pH相等的NaOH和氨水溶液,氨水濃度大于NaOH溶液,加水稀釋促進一水合氨電離,NaOH在溶液中完全電離,據此分析.
解答 解:(1)甲烷燃料電池中,甲烷在負極失電子,氧氣在正極得電子,電極反應式為:O2+4e-+2H2O═4OH-,用總反應式減去正極反應式得負極反應式:CH4-8e-+10OH-=CO32-+7H2O,故答案為:負;CH4-8e-+10OH-=CO32-+7H2O;
(2)先出現紅色,則在陰極上放出氫氣,氫氧根濃度增大,則其極與電源負極相連,為陰極,電極反應式為:2H2O+2e-═H2↑+2OH-,故答案為:陰;2H2O+2e-═H2↑+2OH-;
(3)強酸與強堿反應,可用酚酞作指示劑,滴定前,酚酞遇堿無色,滴定溶液由無色變為粉紅色,且30s內不褪色;
A.錐形瓶用蒸餾水洗后用待測液潤洗,無影響,故不選;
B.在潔凈干燥的堿式滴定管未用標準液潤洗即裝標準液,標準液濃度變小,V(標準)偏大,所以測得HCl溶液濃度偏高,故不選;
C.滴定過程中,錐形瓶內液體濺出瓶外,消耗V(標準)偏小,所以測得HCl溶液濃度偏低,故選;
D.配制NaOH標準溶液定容時仰視容量瓶標線,標準液濃度偏低,濃度變小,所以V(標準)偏大,所以測得HCl溶液濃度偏高,故不選;
故選C;故答案為:酚酞;溶液由無色變為粉紅色,且30s內不褪色;C;
(4)加水稀釋促進一水合氨電離,將等體積、等pH的氫氧化鈉溶液和氨水分別稀釋相同倍數,氨水中氫氧根離子濃度大于NaOH,氨水pH大于NaOH溶液,若使稀釋后pH相等,氨水稀釋倍數應大于氫氧化鈉,即m<n,故答案為:<.
點評 本題考查了電化學電極反應式的書寫、中和滴定操作、誤差分析、弱電解質存在電離平衡,加水稀釋促進弱電解質的電離,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| X | |||
| Y | Z | R | W |
| A. | 該五種元素一定為非金屬元素 | |
| B. | 元素Y、Z、R的氧化物一定屬于三種不同類型的晶體 | |
| C. | Z的原子序數可能是X的兩倍 | |
| D. | W的最高價氧化物對應的水化物可能是最強的無機含氧酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
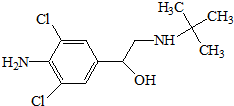 瘦肉精,學名鹽酸克倫特羅,該藥物既不是獸藥,也不是飼料添加劑,而是腎上腺類神經興奮劑,可以增加動物的瘦肉量.減少飼料使用.使肉品提早上市,降低成本,但對人體會產生副作用,鹽酸克倫特羅分子結構簡式如圖.下列說法不正確的是( )
瘦肉精,學名鹽酸克倫特羅,該藥物既不是獸藥,也不是飼料添加劑,而是腎上腺類神經興奮劑,可以增加動物的瘦肉量.減少飼料使用.使肉品提早上市,降低成本,但對人體會產生副作用,鹽酸克倫特羅分子結構簡式如圖.下列說法不正確的是( )| A. | 瘦肉精的分子式是C11H18ON2Cl2 | |
| B. | 物質能發生取代反應、氧化反應、加成反應和水解反應 | |
| C. | 1mol鹽酸克倫特羅最多能與4molNaOH反應 | |
| D. | 鹽酸克倫特羅分子中至少有7個碳原子共面 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣態氫化物的穩定性按X、Y、Z的順序遞增 | |
| B. | 三種元素的最高價氧化物對應的水化物酸性:H2ZO3>H3YO4>H2XO4 | |
| C. | 元素的最高正化合價按X、Y、Z的順序遞減 | |
| D. | 元素原子的半徑按X、Y、Z的順序遞減 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
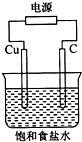
| A. | 石墨電極與直流電源負極相連 | |
| B. | 銅電極的反應式為:2H++2e-═H2↑ | |
| C. | 氫氧化鈉在石墨電極附近產生,Na+向石墨電極遷移 | |
| D. | 用濕潤KI淀粉試劑在銅電極附近檢驗氣體,試紙變藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
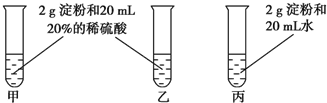 為檢驗淀粉水解的情況,進行如圖所示的實驗,試管甲和丙均用60~80℃的水浴加熱5~6min,試管乙不加熱.待試管甲中的溶液冷卻后再進行后續實驗.
為檢驗淀粉水解的情況,進行如圖所示的實驗,試管甲和丙均用60~80℃的水浴加熱5~6min,試管乙不加熱.待試管甲中的溶液冷卻后再進行后續實驗.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓下,相同體積的物質,其物質的量必然相等 | |
| B. | 任何條件下,等物質的量的乙烯(C2H4)和一氧化碳所含的分子數必然相等 | |
| C. | 10g一氧化碳氣體和10g氧氣的體積相等 | |
| D. | 同溫同壓下,等體積的物質所含的分子數一定相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com