
| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
分析 使Na2O2固體增重5.6 g,發(fā)生反應2Na2O2+2CO2═2Na2CO3+O2;含碳元素的物質(zhì)完全燃燒后再通入足量Na2O2固體,實際增加的為與CO2等物質(zhì)的量的CO的質(zhì)量;含氫的物質(zhì)完全燃燒后再通入足量Na2O2固體,實際增加的為H原子的質(zhì)量,以此來解答.
解答 解:混合氣體直接通入到足量的Na2O2固體中,充分反應后,使Na2O2固體增重5.6 g,發(fā)生反應2Na2O2+2CO2═2Na2CO3+O2,
2Na2O2+2CO2═2Na2CO3+O2 △m
88 32 56
x 5.6g
可知參加反應的CO2的質(zhì)量為$\frac{5.6g}{56}×88$=8.8 g,所以CH4O、CO的質(zhì)量之和為11.2-8.8=2.4 g;
第二次經(jīng)過燃燒后使Na2O2固體增重的反應過程中,根據(jù)反應方程式得到規(guī)律:含碳元素的物質(zhì)完全燃燒后再通入足量Na2O2固體,實際增加的為與CO2等物質(zhì)的量的CO的質(zhì)量;含氫的物質(zhì)完全燃燒后再通入足量Na2O2固體,實際增加的為H原子的質(zhì)量,
則CH4O、CO的質(zhì)量之和就是使Na2O2固體增加的質(zhì)量,再加上CO2使Na2O2固體增重的5.6 g,即2.4g+5.6g=8.0 g,
故選C.
點評 本題考查化學反應方程式的計算,為高頻考點,把握物質(zhì)的性質(zhì)、發(fā)生的反應為解答的關鍵,側(cè)重分析與計算能力的考查,注意固體增重的判斷,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
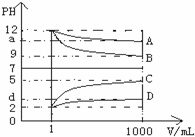
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 銅及其化合物在科學研究和工業(yè)生產(chǎn)中具有許多用途.
銅及其化合物在科學研究和工業(yè)生產(chǎn)中具有許多用途. ;
;查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
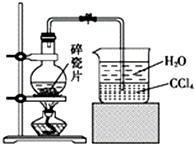 1-溴異戊烷[(CH3)2CHCH2CH2Br]是有機合成的重要中間體,可用于生產(chǎn)染料、催化劑等,其沸點為121℃,易溶于CCl4,可由異戊醇與氫溴酸在硫酸催化作用下反應而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知異戊醇的沸點為132.5℃,微溶于水,易溶于CCl4.實驗室制備1-溴異戊烷的裝置如圖所示.
1-溴異戊烷[(CH3)2CHCH2CH2Br]是有機合成的重要中間體,可用于生產(chǎn)染料、催化劑等,其沸點為121℃,易溶于CCl4,可由異戊醇與氫溴酸在硫酸催化作用下反應而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知異戊醇的沸點為132.5℃,微溶于水,易溶于CCl4.實驗室制備1-溴異戊烷的裝置如圖所示.| 反應物 | NaBr | 98.3% 濃H2SO4 | 異戊醇 | 水 |
| 用量 | 0.30mol | 35mL(過量) | 0.25mol | 30mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化合物 | 相對分子質(zhì)量 | 密度/g•cm-3 | 沸點,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
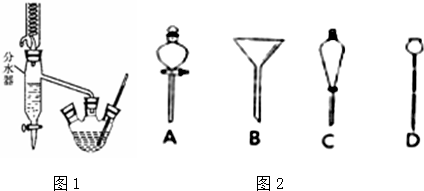
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向NaClO溶液中通入過量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明礬溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com