
(8分)已知:①MnO4—
+e- MnO42―
(綠色)(強堿性條件)
MnO42―
(綠色)(強堿性條件)
②MnO4—+ 8H+ + 5e- Mn2+ (無色)+ 4H2O(強酸性條件)
Mn2+ (無色)+ 4H2O(強酸性條件)
(1)在KOH溶液中,KMnO4與K2SO3溶液發生反應, 寫出反應的離子方程式 。
(2)將KMnO4溶液滴入NaOH溶液微熱,得到透明的綠色溶液,寫出反應的離子方程式 .
(3)用酸性KMnO4溶液與亞鐵鹽的反應證明Fe2+具有還原性,MnO4‑ 具有氧化性,最合適的亞鐵鹽是 (選填編號),可用來酸化KMnO4溶液的試劑是 (選填編號)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 鹽酸 f. 硝酸
(4)向20 mL濃度為0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4‑ 全部轉化為Mn2+ ,則反應前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于 mL
(共8分)(1) 2MnO4—+SO32―+ 2OH—=== 2MnO42―+SO42―+ H2O(2分)
(2) 4MnO4—+4OH—=== MnO42―+2H2O +O2↑(2分)
(3) b d(各1分,共2分)(4)8ml(2分)
【解析】由題目所給條件可知MnO4— 在酸性、堿性條件下氧化能力不同:在強堿性條件下生成MnO42―、在酸性條件下生成Mn2+。
(1)(2)一般是根據化合價的升降守恒、電荷守恒、原子守恒進行離子方程式的配平
(3)由于氯離子可還原MnO4—、NO3—在酸性條件下氧化性很強,故最合適的亞鐵鹽是FeSO4,酸化KMnO4溶液的試劑最好是硫酸
(4)由方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可得所需c(H+)=1mol/L的硫酸體積為:
V=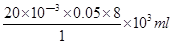 =8
ml
=8
ml


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| △ |
| ||
| 加入藥品 | 不加MnSO4的硫酸 酸化的H2C2O4溶液 |
加少量MnSO4的硫酸 酸化的H2C2O4溶液 |
| 實驗現象 (褪色時間)/s |
H2C2O4褪色很慢 (31秒) |
H2C2O4褪色很快(4秒) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 試管A | 試管B | |
| 加入試劑 | ||
| (預期)實驗現象 (褪色時間) |
||
| 結論 | 猜想Ⅱ正確 | |
查看答案和解析>>
科目:高中化學 來源: 題型:
(8分)工業上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬( FeSO4·7H2O)。
⑴若用98% 1.84 g/cm3的濃硫酸配制生產用28%的硫酸溶液,則濃硫酸與水的體積比約為1: ▲ 。
⑵為測定某久置于空氣的綠礬樣品中Fe2+的氧化率,某同學設計如下實驗:取一定量的樣品溶于足量的稀硫酸中,然后加入5.00 g鐵粉充分反應,收集到224 mL(標準狀況)氣體,剩余固體質量為3.88 g,測得反應后的溶液中Fe2+的物質的量為0.14 mol(不含Fe3+)。則該樣品中Fe2+離子的氧化率為 ▲ 。
⑶硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O](俗稱莫爾鹽),較綠礬穩定,在氧化還原滴定分析中常用來配制Fe2+的標準溶液。現取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液處理,發生反應如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反應后煮沸溶液,趕盡SO2,剩余的KMnO4恰好與V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反應。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范圍為 ▲ ;
②若V=35,試計算混合物中CuS的質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com