解:(1)乙醇能夠被氧化為乙醛,然后乙醛可繼續被氧化為乙酸,則C為乙酸,其結構簡式為CH
3COOH,反應①的化學方程式為2CH
3CH
2OH+O
2
2CH
3CHO+2H
2O;乙醇汽油就是在無鉛汽油里加入適量乙醇混合而成的一種燃料,所以乙醇汽油屬于混合物,該汽油中物質含有C、H、O元素,汽車使用乙醇汽油能減少有害氣體的排放,工業常用裂化的方法提高汽油的產量,用玉米、高粱(主要成分為淀粉)發酵可以制得乙醇,即只有A是一定錯誤的;
故答案為:CH
3COOH;2CH
3CH
2OH+O
2
2CH
3CHO+2H
2O;A;
(2)A是一種工業制硫酸的含金屬元素礦物質主要成分,則A為FeS
2,FeS
2能燃燒生成SO
2,SO
2催化氧化生成SO
3,反應②的化學方程式為2SO
2+O
2
2SO
3,
故答案為:FeS
2;2SO
2+O
2
2SO
3;
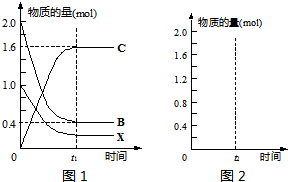
①由圖1可知,參加反應的B的物質的量為1.6mol,則B的轉化率為

×100%=80%,故答案為:80%;
②由圖1可知,平衡時,C
B=
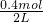
=0.2mol/L,C
X=

=0.1mol/L,C
C=

=0.8mol/L,所以K=

=160,故答案為:160;
③相同條件下,相同的容器中投入2mol C,二者為等效平衡,即達到平衡時與上述平衡中各物質的濃度相同,平衡時X的物質的量為0.2mol,B的物質的量為0.4mol,C的物質的量為1.6mol,如圖所示,

故答案為:

分析:(1)乙醇能夠被氧化為乙醛,然后乙醛可繼續被氧化為乙酸;乙醇汽油屬于混合物;
(2)A是一種工業制硫酸的含金屬元素礦物質主要成分,則A為FeS
2,FeS
2能燃燒生成SO
2,SO
2催化氧化生成SO
3;
①由圖可知,參加反應的B的物質的量為1.6mol,以此計算轉化率;
②根據平衡時各物質的濃度及K的定義式來計算;
③相同條件下,相同的容器中投入2mol C,二者為等效平衡,即達到平衡時與上述平衡中各物質的濃度相同,以此來作圖.
點評:本題考查無機物的推斷及化學平衡的計算,明確乙醇的性質及工業制硫酸的反應、化學平衡常數、轉化率的計算即可解答,注意等效平衡的應用來解答最后一問,題目難度不大.


 2CH3CHO+2H2O;乙醇汽油就是在無鉛汽油里加入適量乙醇混合而成的一種燃料,所以乙醇汽油屬于混合物,該汽油中物質含有C、H、O元素,汽車使用乙醇汽油能減少有害氣體的排放,工業常用裂化的方法提高汽油的產量,用玉米、高粱(主要成分為淀粉)發酵可以制得乙醇,即只有A是一定錯誤的;
2CH3CHO+2H2O;乙醇汽油就是在無鉛汽油里加入適量乙醇混合而成的一種燃料,所以乙醇汽油屬于混合物,該汽油中物質含有C、H、O元素,汽車使用乙醇汽油能減少有害氣體的排放,工業常用裂化的方法提高汽油的產量,用玉米、高粱(主要成分為淀粉)發酵可以制得乙醇,即只有A是一定錯誤的; 2CH3CHO+2H2O;A;
2CH3CHO+2H2O;A; 2SO3,
2SO3, 2SO3;
2SO3; ×100%=80%,故答案為:80%;
×100%=80%,故答案為:80%;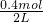 =0.2mol/L,CX=
=0.2mol/L,CX= =0.1mol/L,CC=
=0.1mol/L,CC= =0.8mol/L,所以K=
=0.8mol/L,所以K= =160,故答案為:160;
=160,故答案為:160;






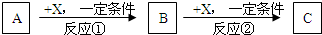

 現有3種化合物A、B、C均含短周期元素R,其轉化關系如圖所示.
現有3種化合物A、B、C均含短周期元素R,其轉化關系如圖所示.
