
 已知H2C2O4為二元中強酸.某化學興趣小組為測定含Na2SO4、NaHC2O4和H2C2O4•2H2O的試樣中各物質的質量分數,進行了如下實驗:
已知H2C2O4為二元中強酸.某化學興趣小組為測定含Na2SO4、NaHC2O4和H2C2O4•2H2O的試樣中各物質的質量分數,進行了如下實驗:分析 (1)NaHC2O4溶液與NaOH溶液反應生成Na2C2O4和水;
(2)配制試樣溶液時所需要的玻璃儀器有燒杯、玻璃棒、量筒、膠頭滴管、250mL容量瓶;
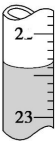
(3)步驟③若滴定終點時溶液的pH=8.3,則應選擇堿性指示劑,滴定管0刻度在上面,每一個小刻度為0.1mL,據此答題;
(4)根據滴定操作要求,眼睛應觀察錐形瓶內溶液顏色的變化;
(5)反應中碳從+3價升為+4價,錳從+7價降為+2價,根據化合升降法及元素守恒和電荷守恒配平離子方程式;
(6)步驟③中,高錳酸鉀溶液有強氧化性,能氧化乳膠管,滴定終點時溶液由無色變成淺紅色;
(7)設樣品中NaHC2O4為xmol,H2C2O4•2H2O為ymol,根據第一份溶液中加2~3滴指示劑,用0.2500mol•L-1 NaOH溶液滴定,消耗NaOH溶液20.00mL可得x+2y=0.2500×0.02mol=0.005mol,根據第二份溶液用0.1000mol•L-1的酸性高錳酸鉀溶液滴定,消耗高錳酸鉀溶液16.00mL,結合電子得失守恒,可得x+y=$\frac{5}{2}$×0.1000×0.016mol=0.004mol,據此計算出NaHC2O4和H2C2O4•2H2O的質量,再確定試樣中Na2SO4的質量分數.
解答 解:(1)NaHC2O4溶液與NaOH溶液反應生成Na2C2O4和水,反應的離子方程式為HC2O4-+OH-=H2O+C2O42-,
故答案為:HC2O4-+OH-=H2O+C2O42-;
(2)配制試樣溶液時所需要的玻璃儀器有燒杯、玻璃棒、量筒、膠頭滴管、250mL容量瓶,
故答案為:膠頭滴管、250mL容量瓶;
(3)步驟③若滴定終點時溶液的pH=8.3,則應選擇堿性指示劑為酚酞,滴定管0刻度在上面,每一個小刻度為0.1mL,所以根據圖上的刻度管內液體的體積應為大于27.60mL,故選d,
故答案為:酚酞;d;
(4)根據滴定操作要求,眼睛應觀察錐形瓶內溶液顏色的變化,
故答案為:錐形瓶內溶液顏色的變化;
(5)反應中碳從+3價升為+4價,錳從+7價降為+2價,根據化合升降法及元素守恒和電荷守恒可知離子方程式為5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案為:5、2、6、10、2、8H2O;
(6)步驟③中,高錳酸鉀溶液有強氧化性,能氧化乳膠管,所以高錳酸鉀溶液應裝在酸式滴定管里,判斷滴定終點的方法是溶液由無色變為淺紅色且在半分鐘內不褪色,
故答案為:酸式;溶液由無色變為淺紅色且在半分鐘內不褪色;
(7)設樣品中NaHC2O4為xmol,H2C2O4•2H2O為ymol,根據第一份溶液中加2~3滴指示劑,用0.2500mol•L-1 NaOH溶液滴定,消耗NaOH溶液20.00mL可得x+2y=0.2500×0.02mol=0.005mol,根據第二份溶液用0.1000mol•L-1的酸性高錳酸鉀溶液滴定,消耗高錳酸鉀溶液16.00mL,結合電子得失守恒,可得x+y=$\frac{5}{2}$×0.1000×0.016mol=0.004mol,所以$\left\{\begin{array}{l}{x+2y=0.005\\;}\\{x+y=0.004}\end{array}\right.$,解得x=0.003,y=0.001,所以10.0g試樣中含有NaHC2O4的質量為$\frac{250}{25}$×112×0.003g=3.36g,H2C2O4•2H2O的質量為$\frac{250}{25}$×126×0.001g=1.26g,則試樣中Na2SO4的質量分數為$\frac{10-1.26-3.36}{10}$×100%=53.8%,
故答案為:53.8%.
點評 本題考查氧化還原滴定原理與應用、探究影響速率的因素,難度中等,理解實驗原理是解題的關鍵,是對知識的綜合運用,需要學生具備扎實的基礎知識與運用知識分析問題、解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 用堿式滴定管準確量取20.00 mL的高錳酸鉀溶液 | |
| B. | 用NaOH滴定鹽酸時,若滴定結束時俯視刻度,會導致測定結果偏高 | |
| C. | 用NaOH滴定鹽酸時,只能用酚酞作指示劑 | |
| D. | 用KMnO4滴定亞硫酸鈉溶液的實驗中不需要另外加入指示劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
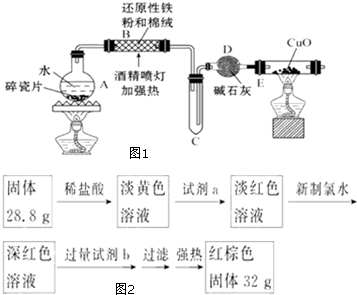 某研究性學習小組請你參與“研究鐵與水反應所得固體物質的成分、性質及再利用”實驗探究,并共同解答下列問題:
某研究性學習小組請你參與“研究鐵與水反應所得固體物質的成分、性質及再利用”實驗探究,并共同解答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
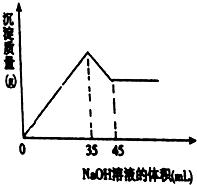
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
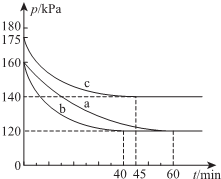 一定條件下,通過下列反應可實現燃煤煙氣中硫的回收:
一定條件下,通過下列反應可實現燃煤煙氣中硫的回收:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
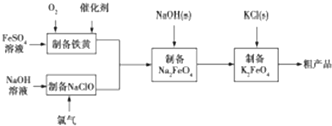
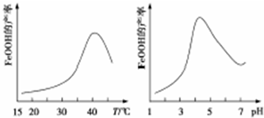
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com