
隨著大氣污染的日趨嚴重,“節能減排”,減少全球溫室氣體排放,研究NOx、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)下圖是在101kPa,298k條件下1mol NO2和1mol CO反應生成1mol CO2和1mol NO過程中能量變化示意圖。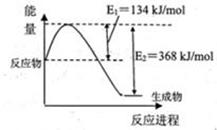
已知:① N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
則在298k時,反應:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H= 。
N2(g)+2CO2(g)的△H= 。
(2)將0.20mol NO2和0.10molCO充入一個容積恒定為1L的密閉容器中發生反應,在不同條件下,反應過程中部分物質的濃度變化狀況如圖所示。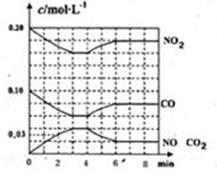
①下列說法正確的是 。(填序號)
a.容器內的壓強不發生變化說明該反應達到平衡
b.當向容器中加再充入0.20mol NO時,平衡向正反應方向移動,K值增大
c.升高溫度后,K值減小,NO2的轉化率減小
d.向該容器內充入He氣,反應物的體積減小,濃度增大,所以反應反應速率增大
②計算產物NO在0~2min時平均反應速率v(NO)= mol·L-1·min-1;
③第4min時改變的反應條件為 (填“升溫”、“降溫”);
④計算反應在第6min時的平衡常數K= 。若保持溫度不變,此時再向容器中充入CO、NO各0.060mol,平衡將 移動(填“正向”、“逆向”或“不”)。
(3)有學者想以如圖所示裝置用原電池原理將SO2轉化為重要的化工原料。其負極的反應式為 ,當有0.25molSO2被吸收,則通過質子(H+)交換膜的H+的物質的量為 。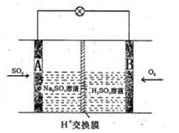
(4)CO2在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其KSP=2.8×10-9mol2/L2。現將2×10-4mol/L的Na2CO3溶液與一定濃度的CaC12溶液等體積混合生成沉淀,計算應加入CaC12溶液的最小濃度為 。
(16分)(1)-759.8kJ/mol (2分) (2)①C (2分) ②0.015 (2分) ③升溫 (2分)
④1/36 (2分) 逆向 (1分) (3)SO2+2H2O-2e-=SO42-+4H+ (2分) 0.5mol (2分)
(4)5.6×10-5mol/L (2分)
解析試題分析:(1)根據圖像可知,反應物的總能量高于生成物的總能量,因此該反應是放熱反應,其反應熱△H=134kJ/mol-368kJ/mol=-234kJ/mol,即熱化學方程式是③ NO2(g)+CO(g) CO2(g)+NO(g) △H=-234kJ/mol。根據蓋斯定律可知,②-①+③×2即得到反應2NO(g)+2CO(g)
CO2(g)+NO(g) △H=-234kJ/mol。根據蓋斯定律可知,②-①+③×2即得到反應2NO(g)+2CO(g) N2(g)+2CO2(g),因此該反應的反應熱△H=-112.3kJ/mol-179.5kJ/mol-234kJ/mol×2=-759.8kJ/mol。
N2(g)+2CO2(g),因此該反應的反應熱△H=-112.3kJ/mol-179.5kJ/mol-234kJ/mol×2=-759.8kJ/mol。
(2)①根據反應NO2(g)+CO(g) CO2(g)+NO(g) △H=-234kJ/mol可知,該反應是體積不變的、放熱的可逆反應,則:
CO2(g)+NO(g) △H=-234kJ/mol可知,該反應是體積不變的、放熱的可逆反應,則:
a.反應前后體積不變,則壓強始終是不變的,所以容器內的壓強不發生變化,不能說明該反應達到平衡,a不正確;
b.平衡常數只與溫度有關系,當向容器中加再充入0.20mol NO時,平衡向逆反應方向移動,K值不變,b不正確;
c.升高溫度后,平衡向逆反應方向移動,因此K值減小,NO2的轉化率減小,c正確;
d.向該容器內充入He氣,容器容積不變,反應物的濃度不變,所以反應反應速率不變,d不正確 ,答案選c。
②根據圖像可知,在0~2min內NO的濃度增加了0.03mol/L,則根據方程式可知,NO2的濃度就減少0.03mol/L,所以產物NO在0~2min時平均反應速率v(NO)=0.03mol/L÷2=0.015mol·L-1·min-1。
③根據圖像可知,在4min時反應物的濃度增加,而生成物的濃度降低,這說明反應向逆反應方向移動。由于正反應是放熱反應,因此改變的條件是升高溫度。
④根據圖像可知,6min時反應重新建立平衡狀態。此時NO和CO2的濃度均是0.02mol/L,NO2和CO的濃度分別是0.18mol/L和0.08mol/L,因此反應在第6min時的平衡常數K=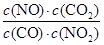 =
= =
=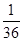 ;若保持溫度不變,此時再向容器中充入CO、NO各0.060mol,則此時
;若保持溫度不變,此時再向容器中充入CO、NO各0.060mol,則此時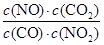 =
= =
=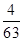 >
>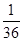 ,因此平衡逆向進行。
,因此平衡逆向進行。
(3)原電池中負極失去電子,所以SO2在負極通入,其電極反應式是SO2+2H2O-2e-=SO42-+4H+;當有0.25molSO2被吸收,則負極生成1.0mol氫離子和0.25mol SO42-,所以要保持電荷守恒,需要將左側多余的0.5mol氫離子通過質子(H+)交換膜交換到右側。
(4)設應加入CaC12溶液的最小濃度為x,則混合后c(Ca2+)=0.5x,c(CO32-)=1×10-4mol/L。根據碳酸鈣的溶度積常數可知,混合要生成沉淀,則0.5x×1×10-4mol/L ≥2.8×10-9mol2/L2,解得x≥5.6×10-5mol/L。
考點:考查反應熱、反應速率、平衡常數以及溶度積常數的有關計算;外界條件對平衡狀態的影響;平衡常數以及原電池原理的應用等


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:填空題
工業碳酸鈉(純度約為98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等雜質,提純工藝線路如圖所示:
Ⅰ.碳酸鈉的飽和溶液在不同溫度下析出的溶質如圖所示: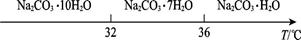
Ⅱ.有關物質的溶度積如下
| 物質 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(16分)最近全國各地持續出現霧霾天氣,其首要污染物是可吸入顆粒物PM2.5和氮、硫的氧化物(PM2.5直徑接近2.5×10-6m,1納米=10-9m),主要來源為工業廢氣、機動車尾氣等。因此對PM2.5、SO2、NOx進行研究、處理意義重大。
(1) 下列關于PM2.5說法正確的是
a.PM2.5在空氣中形成了膠體;
b.PM2.5表面積大,能吸附大量有毒、有害物質;
c.少開私家車,盡量選擇公交、地鐵出行,某種程度可以減少PM2.5污染
(2) 取PM2.5樣本用蒸餾水處理制得試樣,若測得該試樣所含水溶性無機離子及其平均
濃度如下表
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1  2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1 CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1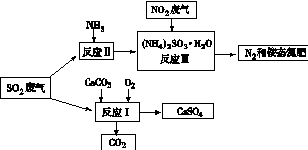
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業上用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。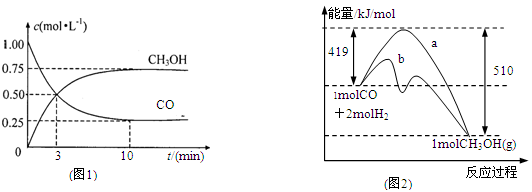
(1)圖1是表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化情況。從反應開始到平衡,用CO濃度變化表示平均反應速率v(CO)=
(2)圖2表示該反應進行過程中能量的變化。曲線a表示不使用催化劑時反應的能量變化,曲線b表示使用催化劑后的能量變化。該反應是_________(選填“吸熱”或“放熱”)反應,寫出反應的熱化學方程式 。
(3)該反應平衡常數K為______________,溫度升高,平衡常數K_________(填“增大”、“不變”或“減小”)
(4)恒容條件下,下列措施中能使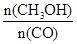 增大的有
增大的有
a.升高溫度 b.充入He氣
c.再充入2 molH2 d.使用催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
能源短缺是人類面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。因此甲醇被稱為21世紀的新型燃料。
(1)已知在常溫常壓下:
①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
②H2O(l) H2O(g) △H="+" 44.0 kJ.mo—1
寫出表示甲醇燃燒熱的熱化學方程式 。
(2)工業上用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g) CH3OH(g)。圖1表示反應中能量的變化;圖2表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化圖。
CH3OH(g)。圖1表示反應中能量的變化;圖2表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化圖。
①在“圖1”中,曲線 (填“a”或“b”)表示使用了催化劑。
②能判斷該反應在“圖2”所在條件下是否已達化學平衡狀態的依據是 。(雙選)
| A.容器中壓強不變 | B.體系的密度不隨時間改變 |
| C.v正(H2)=2v逆(CH3OH) | D.CO與H2的物質的量的比不隨時間改變 |
 CH3OH(g)的化學平衡常數K= 。
CH3OH(g)的化學平衡常數K= 。查看答案和解析>>
科目:高中化學 來源: 題型:計算題
I.甲醇是一種優質燃料,可制作燃料電池。工業上可用下列兩種反應制備甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
則2CO(g)+O2(g)=2CO2(g) 的反應熱ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工業上可利用“甲烷蒸氣轉化法生產氫氣”,反應為:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知溫度、壓強和水碳比[n(H2O)/ n(CH4)]對甲烷平衡含量的影響如下圖: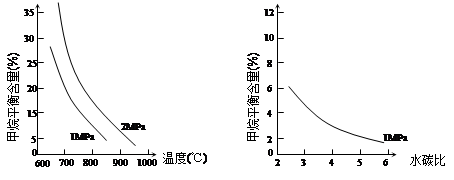
圖1(水碳比為3) 圖2(800℃)
(1)溫度對該反應的反應速率和平衡移動的影響是 。
(2)其他條件不變,請在圖2中畫出壓強為2 MPa時,CH4平衡含量與水碳比之間關系曲線。(只要求畫出大致的變化曲線)
(3)已知:在700℃,1MPa時,1mol CH4與1mol H2O在1L的密閉容器中反應,6分鐘達到平衡,此時CH4的轉化率為80%,求這6分鐘H2的平均反應速率和該溫度下反應的平衡常數是多少?(寫出計算過程,結果保留小數點后一位數字。)
III.某實驗小組設計如圖a所示的電池裝置,正極的電極反應式為____ ____。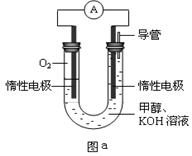
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業合成氨的反應為:N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
某實驗將3.0 mol N2(g)和4. 0 mol H2(g)充入容積為10L的密閉容器中,在溫度T1下反應。測得H2的物質的量隨反應時間的變化如下圖所示。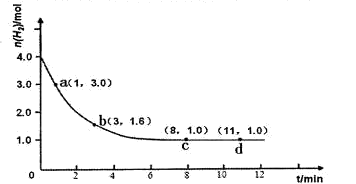
(1)反應開始3min內,H2的平均反應速率為 。
(2)計算該條件下合成氨反應的化學平衡常數(寫出計算過程,結果保留2位有效數字)。
(3)僅改變溫度為T2 ( T2小于TI)再進行實驗,請在答題卡框圖中畫出H2的物質的量隨反應時間變化的預期結果示意圖。
(4)在以煤為主要原料的合成氨工業中,原料氣氫氣常用下述方法獲得:
①C+H2O(g)  CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)  CO2+H2;
CO2+H2;
已知:CO(g)+1/2O2(g)=CO2(g) △H=—283.0kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=—241.8kJ/mol
寫出上述CO與H2O(g)反應的熱化學方程式: 。
(5)合成氨工業中,原料氣(N2、H2混有少量CO、NH3)在進入合成塔之前,用醋酸二氨合銅(I)溶液來吸收CO,其反應為:
CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]?CO △H<0
CH3COO[Cu(NH3)3]?CO △H<0
寫出提高CO吸收率的其中一項措施: 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知:將KI、鹽酸、試劑X和淀粉四種溶液混合,無反應發生。
①向其中滴加雙氧水,發生反應:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即與試劑X反應,當試劑X消耗完后,生成的 I2才會遇淀粉變藍因此,根據試劑X的量、滴入雙氧水至溶液變藍所需的時間,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反應速率。
下表為某同學依據上述原理設計的實驗及實驗記錄(各實驗均在室溫條件下進行):
| 編號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 開始變藍時間(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 雙氧水 | 1 mol·L1 稀鹽酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |

 2AlI3(s)。含Iˉ傳導有機晶體合成物作為電解質,該電池負極的電極反應為:________________________,充電時Al連接電源的___________極。
2AlI3(s)。含Iˉ傳導有機晶體合成物作為電解質,該電池負極的電極反應為:________________________,充電時Al連接電源的___________極。查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在下列影響化學反應速率的因素中,能使化學反應速率加快的方法是( )
①升高溫度 ②加入催化劑 ③增大反應物濃度④將塊狀固體反應物磨成粉末
| A.①②③ | B.①②④ | C.①③④ | D.①②③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com