
【題目】根據如圖所示轉化關系,判斷A、B、C、D各是什么物質,寫出有關的化學方程式:
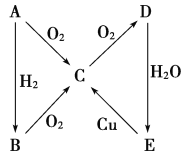
(1)當A為氣體單質時,A是________,B是__________,C是________,D是________,E是________,E→C的化學方程式:_________________________________________________。
(2)當A為固體單質時,A是________,B是________,C是________,D是________,E是________,E→C的化學方程式是_______________________________________________。
【答案】N2 NH3 NO NO2 HNO3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O S H2S SO2 SO3 H2SO4 Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
(1)當A是氣體單質時,A能與氧氣、氫氣反應,且B能發生連續氧化反應,E能和Cu反應生成C,則E為硝酸,所以A是N2,B為NH3,C為NO,D為NO2,E為HNO3;據以上分析解答。
(2)如果A是固體單質,E為酸,能和Cu反應生成C,則E是硫酸, A是S,B是H2S,C是SO2,D是SO3, E是H2SO4;據此分析解答。
(1)當A是氣體單質時,A能與氧氣、氫氣反應,且B能發生連續氧化反應,E能和Cu反應生成C,則E為硝酸,A為氮氣,A和氫氣反應生成B為氨氣,A和氧氣反應生成C為NO, NO被氧氣氧化生成D為二氧化氮,二氧化氮和水反應生成硝酸E,所以當A為氣體單質時,A是N2,B為NH3,C為NO,D為NO2,E為HNO3;稀硝酸和銅反應生成一氧化氮、硝酸銅和水,E→C的化學方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
綜上所述,本題答案是:N2,NH3,NO,NO2,HNO3;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)如果A是固體單質,E為酸,能和Cu反應生成C,則E是濃硫酸,則A為S,A和氫氣反應生成B為H2S,A和氧氣反應生成C為SO2,C被氧氣氧化生成D為SO3;當A為固體單質時,A是S,B是H2S,C是SO2,D是SO3, E是H2SO4;濃硫酸和銅加熱反應生成硫酸銅、二氧化硫和水,E→C的化學方程式:Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
綜上所述,本題答案是:S, H2S, SO2, SO3, H2SO4;Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】工業上,常采用氧化還原方法處理尾氣中的CO、NO。
(氧化處理法)瀝青混凝土可作為反應:2CO(g)+O2(g)![]() 2CO2(g)的催化劑。
2CO2(g)的催化劑。
圖甲表示在相同的恒容密閉容器、相同起始濃度、相同反應時間段下,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
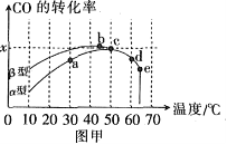
(1)在a、b、c、d四點中,未達到平衡狀態的是___。
(2)已知c點時容器中O2濃度為0.04mol·L-1,則50℃時,在α型瀝青混凝土中CO轉化反應的平衡常數K=___(用含x的代數式表示)。
(3)下列關于圖甲的說法正確的是__。
A.CO轉化反應的平衡常數K(a)<K(c)
B.在均未達到平衡狀態時,同溫下β型瀝青混凝土中CO轉化速率比α型要大
C.b點時CO與O2分子之間發生有效碰撞的幾率在整個實驗過程中最高
D.e點轉化率出現突變的原因可能是溫度升高后催化劑失去活性
(還原處理法)某含鈷催化劑可以催化消除柴油車尾氣中的碳煙(C)和NOx。不同溫度下,將模擬尾氣(含0.025molNO、0.5molO2和足量碳煙)以相同的流速通過該催化劑,測得所有產物(CO2、N2、N2O)與NO的相關數據,結果如圖乙所示。
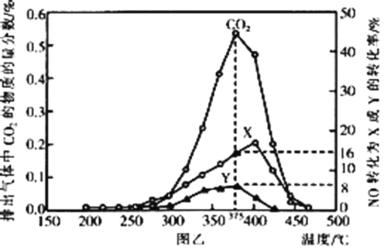
(4)375℃時,測得排出的氣體中含0.45molO2和0.052molCO2,則Y的化學式為___。
(5)實驗過程中采用NO模擬NOx,而不采用NO2的原因是___。
(6)工業上常用高濃度的K2CO3溶液吸收CO2,再利用電解法使K2CO3溶液再生,其裝置示意圖如圖:
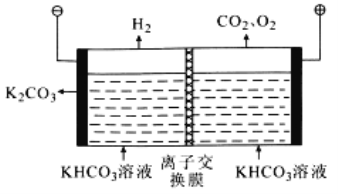
①在陽極區發生的反應包括___和H++HCO3- =CO2↑+H2O
②簡述CO32-在陰極區再生的原理:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是石蠟油在熾熱碎瓷片的作用下產生乙烯并檢驗乙烯性質的實驗,請回答下列問題:

(1)A中碎瓷片的作用是________。
(2)B裝置中反應的化學方程式為__________。
(3)C裝置中可觀察到的現象是_________。
(4)查閱資料.乙烯與酸性高錳酸鉀溶液反應產生二氧化碳,根據本實驗中裝置_____(填裝置字母)中的實驗現象可判斷該資料是否直實。
(5)通過上述實驗探究,檢驗甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 氣體通入水中 B 氣體通過盛溴水的洗氣瓶
C 氣體通過盛酸性高錳酸鉀溶液的洗氣瓶 D 氣體通過氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知亞硫酸鈉晶體與濃硫酸反應可以產生二氧化硫,按下圖進行演示實驗。
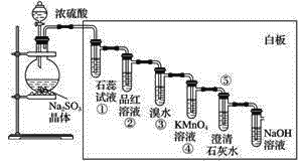
請回答下列問題:
(1)①中的實驗現象是__________,說明二氧化硫具有的性質是__________。
(2)②中的實驗現象是__________,證明二氧化硫有___________性。
(3)③中的實驗現象是_______________,證明二氧化硫有____________性。
(4)④中的實驗現象是__________,證明二氧化硫有______性。
(5)⑤中的實驗現象是_____________,說明二氧化硫具有的性質是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國是世界上較早冶煉鋅的國家。在現代工業中,鋅更是在電池制造、合金生產等領域有著廣泛的用途。
已知:鋅的熔點為419.6℃,沸點907℃。
I.圖是古代以爐甘石(ZnCO3)為原料煉鋅的示意圖。
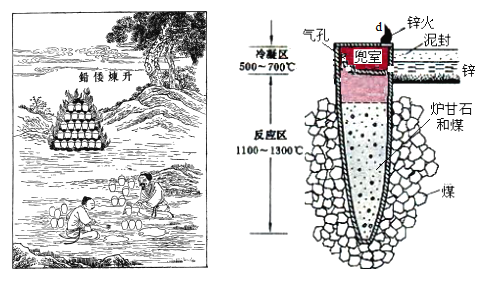
(1)泥罐內的主要反應為:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
總反應:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2計算時H3,還需要利用_________反應的H。
(2)泥罐中,金屬鋅的狀態變化是_____;d口出去的物質主要是_______。
Ⅱ.現代冶煉鋅主要采取濕法工藝。以閃鋅礦(主要成分為ZnS,還含鐵等元素)、軟錳礦(主要成分為MnO2,還含鐵等元素)為原料聯合生產鋅和高純度二氧化錳的一種工藝的主要流程如下:
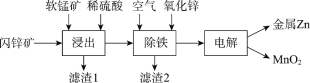
(3)浸出:加入FeSO4能促進ZnS的溶解,提高鋅的浸出率,同時生成硫單質。Fe2+的作用類似催化劑,“催化”過程可表示為:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 寫出ⅱ的離子方程式:_________。
② 下列實驗方案可證實上述“催化”過程。將實驗方案補充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液幾乎無色,再加入少量MnO2,溶液變紅。
b.________。
(4)除鐵:已知①進入除鐵工藝的溶液的pH約為3;②控制溶液pH為2.5~3.5,使鐵主要以FeOOH沉淀的形式除去。結合離子方程式說明,通入空氣需同時補充適量ZnO的理由是_________。
(5)電解:用惰性電極電解時,陽極的電極反應是______。
(6)電解后的溶液中可循環利用的物質是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖為用惰性電極電解制備高錳酸鉀的裝置示意圖如下。下列說法正確的是
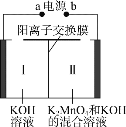
A.a為電源正極
B.Ⅰ中的K+通過陽離子交換膜移向Ⅱ
C.若不使用離子交換膜,KMnO4的產率可能會降低
D.若陰極產生0.2 mol氣體,理論上可得到0.2 mol KMnO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業生產硫酸中二氧化硫的催化氧化原理為:2SO2(g)+O2(g)![]() 2SO3(g),反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如下圖所示。下列說法錯誤的是
2SO3(g),反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如下圖所示。下列說法錯誤的是

A. 在A、B、C三點時,V(正)=v(逆),在D點時V(正)>v(逆)
B. A、B、C三點的平衡常數一定不相同
C. 升高溫度可以加快化學反應速率,有利于平衡向正反應方向移動
D. 一定溫度下,保持容器體積不變,向平衡體系中通人稀有氣體,壓強增大,平衡不移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組通過分析鎂與酸反應時pH的變化,探究鎂與醋酸溶液反應的實質。
(實驗)在常溫水浴條件下,進行實驗Ⅰ~Ⅲ,記錄生成氣體體積和溶液pH的變化:
Ⅰ.取0.1 g光亮的鎂屑(過量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的鎂屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的鎂屑放入10 mL pH = 2.9 HCl溶液中。
(數據)
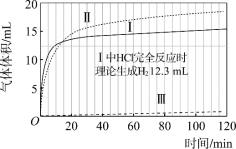
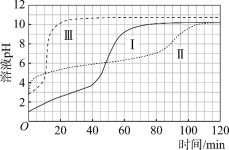
圖1 圖2
(1)起始階段,Ⅰ中主要反應的離子方程式是____。
(2)Ⅱ起始溶液中![]() 約為____。(選填“1”、“10”或“102”)
約為____。(選填“1”、“10”或“102”)
(3)起始階段,導致Ⅱ、Ⅲ氣體產生速率差異的主要因素不是c(H+),實驗證據是____。
(4)探究Ⅱ的反應速率大于Ⅲ的原因。
提出假設:CH3COOH能直接與Mg反應。
進行實驗Ⅳ:____。
得出結論:該假設成立。
(5)探究醋酸溶液中與Mg反應的主要微粒,進行實驗Ⅴ。
與Ⅱ相同的條件和試劑用量,將溶液換成含0.10 mol·L–1的 CH3COOH與0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),氣體產生速率與Ⅱ對比如下。
a.實驗Ⅴ起始速率 | b.實驗Ⅱ起始速率 | c.實驗ⅡpH=4.8時速率 |
2.1 mL·min–1 | 2.3 mL·min–1 | 0.8 mL·min–1 |
對比a~c中的微粒濃度,解釋其a與b、a與c氣體產生速率差異的原因:____。
(6)綜合以上實驗得出結論:
①鎂與醋酸溶液反應時,CH3COOH、H+、H2O均能與鎂反應產生氫氣;
②____。
(7)實驗反思:120 min附近,Ⅰ~ⅢpH均基本不變,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),解釋其原因:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究人員采用雙極膜將酸-堿電解液隔離,實現MnO2/Mn2+和Zn/![]() 的兩個溶解/沉積電極氧化還原反應,研制出新型高比能液流電池,其放電過程原理示意圖如下:
的兩個溶解/沉積電極氧化還原反應,研制出新型高比能液流電池,其放電過程原理示意圖如下:
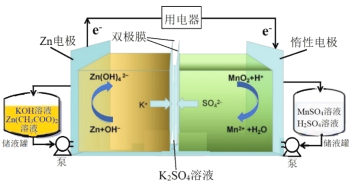
下列說法不正確的是
A.放電過程中,總反應方程式為Zn+MnO2+4OH-+4H+===![]() +Mn2++2H2O
+Mn2++2H2O
B.放電過程中,當1molZn參與反應時,理論上有4molK+發生遷移
C.充電過程中,陰極的電極反應為![]() +2e-===Zn+4OH-
+2e-===Zn+4OH-
D.充電過程中,右側池中溶液pH逐漸減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com