
 苯甲酸的分子式為C6H5COOH,分子結構為
苯甲酸的分子式為C6H5COOH,分子結構為 ,是苯環上的一個氫被羧基(-COOH)取代形成的化合物.其化學性質與乙酸類似,具有弱酸性,并可以和乙醇發生酯化反應生成苯甲酸乙酯.
,是苯環上的一個氫被羧基(-COOH)取代形成的化合物.其化學性質與乙酸類似,具有弱酸性,并可以和乙醇發生酯化反應生成苯甲酸乙酯. +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$ +H2O;實驗中使用分水器的目的是分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;.
+H2O;實驗中使用分水器的目的是分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;.分析 (1)化學反應方程式為: +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$ +H2O,分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;
+H2O,分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;
(2)沸點低的物質先被蒸餾得到;三元共沸物中環己烷含量最大,乙醇是過量物質,所以再次蒸餾得到乙醇和環己烷;溫度低于苯甲酸乙酯的沸點時,苯甲酸乙酯不被蒸餾出;
(3)堿性物質能中和酸性物質且酯在碳酸鈉溶液中的溶解度較小;分離互不相溶的液體采用分液的方法分離,乙醚為常用有機溶劑,水溶性較差,可以萃取生成的酯分離出來;
(4)乙醚易揮發,說明乙醚沸點較低,苯甲酸乙酯沸點高于乙醚,依據物質沸點不同,通過控制溫度蒸餾得到乙醚和酯.
解答 解:(1)根據題干信息知,苯甲酸和乙醇反應生成苯甲酸乙酯和水,化學反應方程式為: +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$ +H2O,
+H2O,
故答案為: +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$ +H2O,水-乙醇-環己烷能形成三元共沸物,導致水量減少,生成物的量減少,導致平衡向正反應方向移動,分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;
+H2O,水-乙醇-環己烷能形成三元共沸物,導致水量減少,生成物的量減少,導致平衡向正反應方向移動,分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;
故答案為: +CH3CH2OH$?_{△}^{濃硫酸}$
+CH3CH2OH$?_{△}^{濃硫酸}$ +H2O,分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;
+H2O,分離出生成的水,有利于平衡向生成乙酸正丁酯的方向移動;
(2)沸點低的物質先被蒸餾得到,三元共沸物的熔點較低,導致三元共沸物先被蒸餾得到,所以該液體的三種主要成分是水、乙醇、環己烷;
故答案為:水、乙醇、環己烷;
(3)碳酸鈉為強堿弱酸鹽,碳酸鈉溶液呈堿性,能和酸反應而除去酸,碳酸鈉溶液能降低酯的溶解度,所以碳酸鈉溶液的作用是:除去產品中的酸性雜質、降低苯甲酸乙酯的溶解度,所以用飽和碳酸鈉溶液中和至弱堿性,除去乙酸、乙醇,分離互不相溶的液體采用分液的方法分離,需要的儀器為分液漏斗,分液,分出有機層粗產品,水層用乙醚萃取分離,
故答案為:飽和碳酸鈉;萃取;
(4)乙醚易揮發說明乙醚的沸點較低,苯甲酸乙酯沸點較高,加熱時,沸點低的先蒸出、沸點高的后蒸出,所以將醚層加入到干燥的蒸餾燒瓶中進行蒸餾操作,先蒸出乙醚、后蒸出苯甲酸乙酯,
故答案為:蒸餾,乙醚;
點評 本題考查了物質制備,明確實驗原理是解本題關鍵,根據實驗原理及物質的性質來分析解答,很多學生對有機化學實驗知識了解較少,解答時易出現錯誤,要熟練掌握教材基礎知識,靈活運用基礎知識來分析解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 溶液中各離子的濃度都減小 | B. | c(Cl-)/c(NH4+)減小 | ||
| C. | c(H+)/c(NH4+)增大 | D. | c(H+)•c(OH-)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
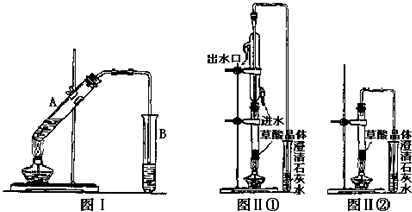
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 醇脫水是合成烯烴的常用方法,實驗室合成己烯的反應和實驗裝置如圖:
醇脫水是合成烯烴的常用方法,實驗室合成己烯的反應和實驗裝置如圖:| 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 溶解性 | |
| 環己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 環己烯 | 82 | 0.8102 | 83 | 難溶于水 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
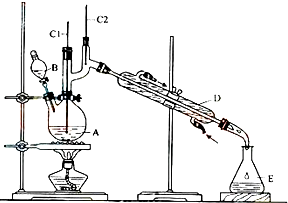
| 沸點/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
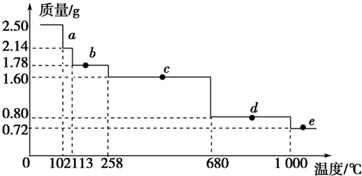
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
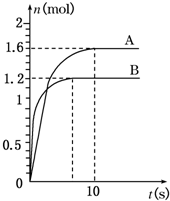
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com