
【題目】下圖所示是從鋁土礦(主要成分是Al2O3,含Fe2O3、SiO2等雜質)中提取氧化鋁的工藝流程之一。

回答下列問題:
(1)用鹽酸溶解鋁土礦后,所得溶液中的陽離子有_____________;
(2)固體A的主要成分是________;
(3)進行步驟Ⅱ時,為了達到分離要求,加入的NaOH應該_____(填少量或過量)。
(4)進行步驟Ⅲ時,一般通入過量CO2,其反應的離子方程式是________;
(5)溶液X和鹽酸反應的化學方程式為_______________________。
【答案】Fe3+、Al3+、H+ SiO2 過量 AlO2-+CO2+2H2O===HCO3-+Al(OH)3↓ NaHCO3+HCl===H2O+CO2↑+NaCl
【解析】
鋁土礦主要成分是![]() ,含
,含![]() 、
、![]() 雜質,其中氧化鋁、氧化鐵能和鹽酸反應,二氧化硅和鹽酸不反應,所以固體A為
雜質,其中氧化鋁、氧化鐵能和鹽酸反應,二氧化硅和鹽酸不反應,所以固體A為![]() ,加入氫氧化鈉的目的是分離鐵離子和鋁離子,應該加入過量的氫氧化鈉,鐵離子生成氫氧化鐵沉淀,鋁離子生成偏鋁酸根,通入二氧化碳后偏鋁酸根生成氫氧化鋁沉淀,灼燒氫氧化鋁生成氧化鋁。
,加入氫氧化鈉的目的是分離鐵離子和鋁離子,應該加入過量的氫氧化鈉,鐵離子生成氫氧化鐵沉淀,鋁離子生成偏鋁酸根,通入二氧化碳后偏鋁酸根生成氫氧化鋁沉淀,灼燒氫氧化鋁生成氧化鋁。
(1)鋁土礦主要成分是![]() ,含
,含![]() 、
、![]() 雜質,其中氧化鋁、氧化鐵能和鹽酸反應,二氧化硅和鹽酸不反應,且鹽酸過量,故所得溶液中的陽離子有鋁離子、鐵離子和氫離子,
雜質,其中氧化鋁、氧化鐵能和鹽酸反應,二氧化硅和鹽酸不反應,且鹽酸過量,故所得溶液中的陽離子有鋁離子、鐵離子和氫離子,
故答案為:![]() ;
;
(2)二氧化硅和鹽酸不反應,所以固體A為![]() ,
,
故答案為:![]() ;
;
(3)加入氫氧化鈉的目的是分離鐵離子和鋁離子,應該加入過量的氫氧化鈉,鐵離子生成氫氧化鐵沉淀,鋁離子生成偏鋁酸根,
故答案為:過量;
(4)通入過量![]() 后,偏鋁酸根生成氫氧化鋁沉淀,
后,偏鋁酸根生成氫氧化鋁沉淀,![]() 過量所以生成碳酸氫根,離子方程式為:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
過量所以生成碳酸氫根,離子方程式為:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案為:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)溶液X為碳酸氫鈉溶液,和鹽酸反應的方程式為:NaHCO3+HCl=H2O+CO2↑+NaCl,
故答案為:NaHCO3+HCl=H2O+CO2↑+NaCl。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】原子結構與元素周期表存在著內在聯系。根據所學物質結構知識,請你回答下列問題:
(1)請按要求任意寫一個相應物質:(填化學式)含有非極性鍵的離子化合物________,既含有非極性鍵又含極性鍵的非極性分子________,既含有非極性鍵又含極性鍵的極性分子________,全部由非金屬元素組成的離子化合物________,由金屬元素和非金屬元素組成的共價化合物________。
(2)蘇丹紅顏色鮮艷、價格低廉,常被一些企業非法作為食品和化妝品等的染色劑,嚴重危害人們健康。蘇丹紅常見有Ⅰ、Ⅱ、Ⅲ、Ⅳ4種類型,蘇丹紅Ⅰ的分子結構如圖所示。


蘇丹紅Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羥基取代在對位形成圖所示的結構,則其在水中的溶解度會________(填“增大”或“減小”),原因是_____________________________________。
(3)已知Ti3+可形成配位數為6,顏色不同的兩種配合物晶體,一種為紫色,另一種為綠色。兩種晶體的組成皆為TiCl3·6H2O。為測定這兩種晶體的化學式,設計了如下實驗:
a.分別取等質量的兩種配合物晶體的樣品配成待測溶液;
b.分別往待測溶液中滴入AgNO3溶液,均產生白色沉淀;
c.沉淀完全后分別過濾得兩份沉淀,經洗滌干燥后稱量,發現原綠色晶體的水溶液得到的白色沉淀質量為原紫色晶體的水溶液得到的沉淀質量的2/3。則綠色晶體配合物的化學式為________________,由Cl-所形成的化學鍵類型是________。
(4)下圖中A,B,C,D四條曲線分別表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氫化物的沸點,其中表示ⅦA族元素氫化物沸點的曲線是________;表示ⅣA族元素氫化物沸點的曲線是________;同一族中第3、4、5周期元素的氫化物沸點依次升高,其原因是_____________________________;A,B,C曲線中第二周期元素的氫化物的沸點顯著高于第三周期元素的氫化物的沸點,其原因是_______________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在生活中 Na2CO3和NaHCO3都可作食用堿。下列對其性質的描述用化學方程式或離子方程式表示正確的是
A.NaHCO3可作發酵粉:2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
B.飽和Na2CO3溶液中通入CO2: CO32- +CO2+ H2O → HCO3-
C.Na2CO3溶液呈堿性:CO32-+ 2H2O → H2CO3+ 2OH-
D.飽和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32- + 2H+ →CO2↑ + H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明N2O與CO在Fe+作用下發生反應的能量變化及反應歷程如圖所示,下列說法錯誤的是
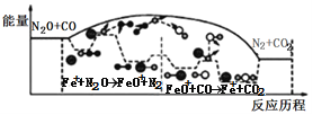
A.反應總過程是放熱的
B.Fe+作為催化劑改變了反應途徑,提高了反應速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 兩步反應均為放熱反應
D.若反應在恒容密閉容器中進行,溫度越高,反應速率一定越快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同溫同壓下,質量相同的CO2、H2、O2、CH4、SO2五種氣體,下列說法錯誤的是
A.所占的體積由大到小的順序是:H2>CH4>O2>CO2>SO2
B.所含分子數由多到少的順序是:H2>CH4>O2>CO2>SO2
C.所含的電子數由多到少的順序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的順序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,反應2A(g)+2B(g)![]() 3C(g)+D(g)在恒容容器中進行,達到化學平衡的標志是( )
3C(g)+D(g)在恒容容器中進行,達到化學平衡的標志是( )
A. 單位時間內生成2n molB,同時消耗3n molCB. 容器內壓強不隨時間變化
C. 混合氣體的密度不隨時間變化D. B物質的百分含量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,相同濃度的兩種一元酸HX、HY分別用同一濃度的NaOH標準溶液滴定,滴定曲線如圖所示。下列說法正確的是![]()
![]()
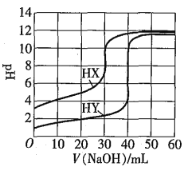
A.HX、HY起始溶液體積相同
B.均可用甲基橙作滴定指示劑
C.pH相同的兩種酸溶液中:![]()
D.同濃度KX與HX的混合溶液中,粒子濃度間存在關系式:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2.9 g鎂鋁合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的體積是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種微生物燃料電池的結構示意圖如下所示,關于該電池的敘述正確的是( )

A. 電池工作時,電子由a流向b
B. 微生物所在電極區放電時發生還原反應
C. 放電過程中,H+從正極區移向負極區
D. 正極反應式為:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com