解:(1)A.硫酸廠廠址的選擇綜合經濟效益考慮,硫酸產品的運輸成本要高于原料黃鐵礦的運輸成本,故A不正確;
B.風光秀麗的旅游城市,不靠近原料基地,也不靠近消耗硫酸的工業城市,導致原料運輸與產品運輸成本高,同時還會對旅游城市造成污染,故B不正確;
C.由于硫酸產品的運輸成本要高于原料黃鐵礦的運輸成本,所以廠址應選擇在消耗硫酸甚多的工業城市,故C正確;
D.人口稠密的文化、商業中心城市,遠離原料基地和消耗硫酸的工業城市,同時為了防止污染環境,不宜考慮作為硫酸廠廠址,故D不正確;
故答案為:C;
(2)根據題意可知,高溫煅燒時CuFeS
2時,反應物為CuFeS
2和O
2,生成物為CuO、Fe
2O
3 和SO
2,再根據化合價升降法配平氧化還原反應方程式,
故答案為:4CuFeS
2+13O
2
4CuO+2Fe
2O
3+8SO
2;
(3)三氧化硫用98.3%的濃硫酸吸收,目的是防止形成酸霧,以提高三氧化硫的吸收效率,故答案為:98.3%的濃硫酸;
(4)已知反應2SO
2+O
2?2SO
3△H<0,現將0.050mol SO
2和0.030mol O
2充入容積為1L的密閉容器中,反應在一定條件下達到平衡,設反應的二氧化硫物質的量為X:依據三段式列式:
2SO
2 +O
2 ?2SO
3起始量(mol) 0.050 0.030 0
變化量(mol) X 0.5X X
平衡量(mol) 0.05-X 0.03-0.5X X
測得反應后容器壓強縮小到原來壓強的75%,所以壓強之比等于物質的量之比;
得到 0.05-X+0.03-0.5X+X=(0.050+0.030)×75%
解得:X=0.04mol;
則二氧化硫的轉化率=

×100%=80%;
平衡狀態物質的平衡濃度為:c(SO
2)=0.01mol/L;c(O
2)=0.01mol/L;c(SO
3)=0.04mol/L;
平衡常數K=

=

=1.6×10
3;
故答案為:80%;1.6×10
3;
(5)硫酸廠沸騰爐排出的礦渣中含有Fe
2O
3、CuO、CuSO
4(由CuO與SO
3 在沸騰爐中化合而成),根據題意由表中數據可知,硫酸銅的質量分數隨沸騰爐溫度升高而降低,是因為反應CuO+SO
3
CuSO
4中SO
3的質量減少導致的,根據2SO
2(g)+O
2(g)

2SO
3(g)),△H=-98.3kJ?mol
-1反應制備SO
3,該反應為可逆反應,正方向為放熱,隨著溫度升高,平衡逆向移動,導致SO
3的量減少,由CuO與SO
3 在沸騰爐中化合而成CuSO
4的量也減少,
故答案為:SO
2轉化為SO
3是正反應放熱的可逆反應,隨溫度升高,平衡左移,SO
3物質的量減少,所以CuSO
4的量減少(或溫度升高,SO
3物質的量減少,故CuSO
4的量減少);
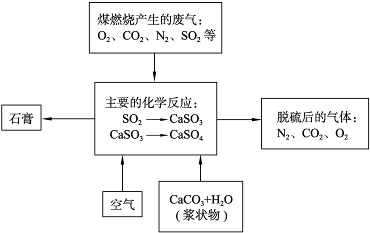
(6)在硫酸工業尾氣中,SO
2是主要大氣污染物,也是酸性氧化物,進行凈化處理時可以用堿液吸收,如NaOH、氨水、石灰水等,生成亞硫酸鹽,然后再用硫酸處理,重新生成SO
2和一種生產水泥的輔料,則堿液可選擇石灰水,反應為SO
2+Ca(OH)
2═CaSO
3↓+H
2O、CaSO
3+H
2SO
4═CaSO
4+SO
2↑+H
2O,
故答案為:石灰水;SO
2+Ca(OH)
2═CaSO
3↓+H
2O、CaSO
3+H
2SO
4═CaSO
4+SO
2↑+H
2O.
分析:(1)硫酸廠廠址的選擇從綜合經濟效益考慮,主要是硫酸為危險品,硫酸的運輸成本要高于原料黃鐵礦的運輸成本;
(2)根據已知信息,確定出反應物和生成物,然后配平化學方程式;
(3)三氧化硫用98.3%的濃硫酸吸收,目的是防止形成酸霧,以提高三氧化硫的吸收效率;
(4)依據化學平衡的三段式列式計算,依據轉化率、平衡常數的概念計算得到;相同條件下氣體壓強之比等于物質的量之比;
(5)由表中數據分析出溫度和CuSO
4的質量分數之間的關系,而CuSO
4的質量取決于SO
3 的質量,再由反應2SO
2(g)+O
2(g)?2SO
3(g)△H=-98.3kJ?mol
-1,分析SO
3 的質量和溫度之間的關系;
(6)硫酸工業尾氣中SO
2凈化處理方法很多,SO
2是酸性氧化物,因此常用堿液吸收,如氨水、氫氧化鈉溶液、石灰水等,再結合題意要獲得生產水泥的輔料,即可確定選擇的試劑;寫出化學方程式.
點評:本題考查工業接觸法制硫酸的相關細節,如原料的選擇、反應條件的選擇、熱交換器的作用、工業尾氣的處理、硫酸廠址的選擇、含硫礦石的煅燒等相關內容,化學平衡的基本計算,轉化率、平衡常數的概念計算應用,只要了解基礎知識都能迎刃而解,難度中等.

 4CuO+2Fe2O3+8SO2;
4CuO+2Fe2O3+8SO2;  ×100%=80%;
×100%=80%; =
= =1.6×103;
=1.6×103; CuSO4中SO3的質量減少導致的,根據2SO2(g)+O2(g)
CuSO4中SO3的質量減少導致的,根據2SO2(g)+O2(g) 2SO3(g)),△H=-98.3kJ?mol-1反應制備SO3,該反應為可逆反應,正方向為放熱,隨著溫度升高,平衡逆向移動,導致SO3的量減少,由CuO與SO3 在沸騰爐中化合而成CuSO4的量也減少,
2SO3(g)),△H=-98.3kJ?mol-1反應制備SO3,該反應為可逆反應,正方向為放熱,隨著溫度升高,平衡逆向移動,導致SO3的量減少,由CuO與SO3 在沸騰爐中化合而成CuSO4的量也減少,