
硫酸亞錫(SnSO4)可用于鍍錫工業.某小組設計SnSO4制備路線為:

查閱資料:
Ⅰ.酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成堿式氯化亞錫
(1)錫原子的核電荷數為50,與碳元素同處ⅣA族,錫位于周期表的第 周期(1分)
(2)操作Ⅰ是 過濾、洗滌等(2分)
(3)溶解SnCl2粉末需加濃鹽酸,原因是
(4)加入Sn粉的作用有兩個:①調節溶液pH ②
(5)反應Ⅰ得到沉淀是SnO,得到該沉淀的離子反應方程式是
(6)酸性條件下,SnSO4與雙氧水去反應的離子方程式是
(7)該小組通過下列方法測定所用錫粉的純度(雜質不參與反應):
①將試樣溶于鹽酸中,發生的反應為:Sn+2HCl═SnCl2+H2↑;
②加入過量的FeCl3;
③用已知濃度的K2Cr2O7滴定②生成的Fe2+,再計算錫粉的純度,請配平方程式:
FeCl2 + K2Cr2O7
+ HCl = FeCl3
+ KCl + CrCl2+

32.(16分)(1)第五周期(1分); (2)蒸發濃縮、冷卻結晶(2分);
(3) 抑制Sn2+ 的水解(2分); (4)防止Sn2+ 被氧化(2分);
(5)SnCl2 + Na2CO3 = SnO↓+ CO2↑+ 2NaCl(3分,未寫↓和↑符號共扣1分,未配平扣1分)
(6)Sn2+ + H2O2 +2H+ = Sn4 + + 2H2O (3分,未配平扣1分)
(7)③ 6 1 14 6 2 2 7 H2O(3分,化學式H2O給1分,系數全對2分)
【解析】
試題分析: 解:(1)錫元素與碳元素屬于同一主族,處于ⅣA族,原子核電荷數為50,則:50-2-8-8-18=14,故Sn處于第五周期。
(2)由流程圖可知,操作Ⅰ是從溶液中得到含結晶水的晶體,只能采取蒸發濃縮、冷卻結晶、過濾、洗滌得到。
(3)由信息可知,SnCl2易水解生成堿式氯化亞錫,存在水解平衡SnCl2+H2O Sn(OH)Cl+HCl,加入鹽酸,使該平衡向左移動,抑制Sn2+水解。
Sn(OH)Cl+HCl,加入鹽酸,使該平衡向左移動,抑制Sn2+水解。
(4)由信息可知,Sn2+易被氧化,加入Sn粉除調節溶液pH外,還防止Sn2+被氧化;
(5)反應Ⅰ得到沉淀是SnO,Sn元素化合價為變化,屬于非氧化還原反應,同時生成氣體,該氣體為二氧化碳,反應方程式為:SnCl2 + Na2CO3 = SnO↓+ CO2↑+ 2NaCl。
(6)酸性條件下,SnSO4還可以用作雙氧水去除劑,雙氧水有強氧化性,將Sn2+易被氧化為Sn4+,自身被還原為水,離子方程式為:Sn2++H2O2+2H+═Sn4++2H2O。
(7)反應物中有H元素,所以在酸性條件下生成物必為H2O,所以根據的是電子守恒配平的方程式為:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
考點:本題考查的是化工流程題。


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源:2013-2014學年山東省淄博市高三3月模擬考試理綜化學試卷(解析版) 題型:填空題
硫酸亞錫(SnSO4)、四氯化錫(SnCl4)常用于印染和電鍍工業。
(1)某研究小組設計SnSO4制備路線如下:

已知:酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化;SnCl2極易水解。
①SnCl2酸溶后加入Sn粉的作用是??????????????????????? 。
②步驟Ⅱ中用到的玻璃儀器除燒杯外還有????????????? ;步驟Ⅳ中需要洗滌固體SnO中含有的雜質,檢驗SnO中的Cl-是否洗滌干凈的操作為???????????????? 。
③步驟Ⅴ涉及到的操作有:a.過濾? b.洗滌? c.蒸發濃縮? d.冷卻結晶? e.低溫干燥,則其正確的操作順序為??????????????????????? 。
(2)實驗室擬用以下裝置,用熔融的金屬錫與干燥純凈的氯氣制取無水SnCl4(SnCl4熔點-33℃,沸點114.1℃,遇潮濕空氣極易水解),此反應過程放出大量的熱。
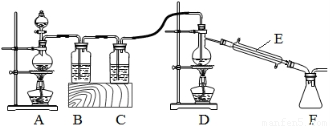
①裝置C中應加入試劑為___________;儀器E的名稱為____________________。
②反應開始生成SnCl4時,可以先熄滅___(填字母序號)處的酒精燈,理由是________。
③該實驗裝置設計尚存在缺陷,改進的方法是(包括儀器、試劑及連接位置等)______________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年安徽省“江南十校”高三3月聯考理綜化學試卷(解析版) 題型:填空題
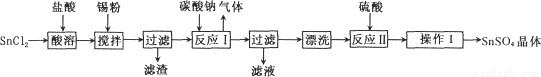
硫酸亞錫(SnSO4)是一種重要的能溶于水的硫酸鹽,廣泛應用于鍍錫工業。某研究小組
設計SnSO4制備路線如下:
查閱資料:
I.酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成堿式氯化亞錫[Sn(OH)Cl]
回答下列問題:
(1)操作l的步驟為 ____、____、過濾、洗滌、干燥。對沉淀進行洗滌的方法是_____________。
(2) SnCl2粉末需加濃鹽酸進行溶解,請結合必要的化學方程式用平衡移動原理解釋原因:________。
(3)加入Sn粉的作用有兩個:①調節溶液pH;②__________。
(4)酸性條件下,SnSO4還可以用作雙氧水去除劑,發生反應的離子方程式是:________________。
(5)該小組通過下列方法測定所用錫粉的純度(雜質不參與反應):取ag錫粉溶于鹽酸中,向生成的SnC12中加入過量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性環境下,Cr2O72-可被還原為Cr3+),共用去K2Cr2O7溶液m ml。則錫粉中錫的質量分數是________。(Sn的摩爾質量為M g/mol,用含a、b、m、M的代數式表示)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省濟寧市高三上學期期末考試化學試卷(解析版) 題型:實驗題
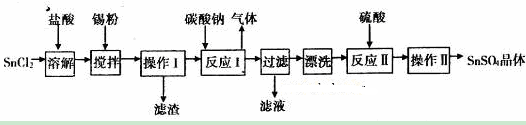
硫酸亞錫(SuSO4)是一種重要的硫酸鹽,廣泛應用于鍍錫工業。某研究小組設計SnSO4制備路線如下:
查閱資料:
I.酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化。
II.SnC12易水解生成堿式氯化亞錫[Sn(OH)Cl]。
回答下列問題:
(1)SnC12粉末需要加濃鹽酸進行溶解,請用化學方程式說明原因___________________。
(2)在SnC12溶液中加入Sn粉的作用有兩個:①調節溶液pH ②_________________。
(3)操作I中使用的玻璃儀器有___________________。
(4)該小組通過下列方法測定所用錫粉的純度(雜質不參與反應):
①將試樣溶于鹽酸中,發生的反應為:Sn+2HCl═SnCl2+H2↑;
②加入過量的FeCl3,發生的反應為:SnCl2+ FeCl3= SnCl4+ FeCl2
③用已知濃度的K2Cr2O7滴定生成的Fe2+,發生的反應為:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
滴定時,K2Cr2O7溶液應該裝在____________(填“酸式”或“堿式”)滴定管中。
若取2.0g錫粉,經上述各步反應后,共用去0.100mol/L K2Cr2O7溶液40.00mL,錫粉中錫的質量分數是____________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市閘北區高三上學期期末考試化學試卷(解析版) 題型:實驗題
硫酸亞錫(SnSO4)是一種重要的硫酸鹽,主要用于電鍍工業的鍍錫、鋁合金表面的氧化著色、印染工業的媒染劑、雙氧水去除劑等。某研究小組設計SnSO4制備路線如下:

查閱資料:
Ⅰ.酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成難溶物Sn(OH)Cl(堿式氯化亞錫)。
請回答下列問題:
(1)SnCl2粉末需加濃鹽酸進行溶解,請用平衡移動原理解釋原因 。
(2)加入Sn粉的作用有兩個:①調節溶液pH ② 。
(3)反應Ⅰ生成的氣體為CO2,得到的沉淀是SnO。該沉淀經過濾后需漂洗,如何證明沉淀已經洗滌完全? 。
(4)多步操作包含的具體實驗步驟的名稱可以是: 。
(5)酸性條件下,SnSO4還可以用作雙氧水去除劑,發生反應的離子方程式是 。
(6)該小組通過下列方法測所用錫粉樣品的純度(雜質不參與反應):
①將試樣溶于鹽酸中,發生的反應為:Sn + 2HCl→SnCl2 + H2↑;
②加入過量的FeCl3 ;
③用已知濃度的K2Cr2O7滴定生成的Fe2+,發生的反應為:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 錫粉樣品,經上述各步反應后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。則該錫粉樣品中錫的質量分數是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com