
分析 (1)①MnOOH中O元素化合價為-2價、H元素化合價為+1價,該化學式中各元素化合價的代數和為1確定Mn的化合價;主族元素原子核外電子層數與其周期數相同,最外層電子數與其族序數相等,據此判斷O在元素周期表的位置;
②根據減少的質量與生成的二氧化錳之間的關系式計算;
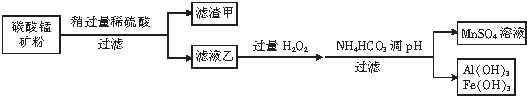
(2)碳酸錳礦主要成分為MnCO3、MnO2、FeCO3、SiO2、Al2O3,將碳酸錳礦中加入稍過量的稀硫酸,MnCO3、FeCO3、Al2O3和稀硫酸反應分別生成MnSO4、FeSO4、Al2(SO4)3,MnO2氧化性大于Fe3+,則MnO2和Fe2+在酸性條件下發生反應MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,SiO2不反應,過濾后,濾渣成分為SiO2,濾液乙中含有MnSO4、Al2(SO4)3、Fe2(SO4)3,向濾液乙中加入過量雙氧水,然后加入碳酸氫銨調節溶液的pH,過濾得到沉淀Al(OH)3、Fe(OH)3,濾液中溶質為MnSO4,
①反應物接觸面積越大,反應速率越快;
②在濾液乙中錳元素只以Mn2十的形式存在,且濾渣甲中不含MnO2,則濾渣甲的主要成分是不溶于稀硫酸的二氧化硅;
酸性條件下,二氧化錳和亞鐵離子發生氧化還原反應生成錳離子、鐵離子和水;
③Fe3+完全沉淀時c(OH-)≥$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L、Al3+完全沉淀時c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L>$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L,鐵離子需要的pH較小,鋁離子需要的pH較大;如果使這兩種兩種都完全沉淀,則溶液中c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L,據此計算溶液的pH,根據溶度積常數計算此時溶液中Mn2十的濃度;
(3)KMnO4分解時Mn元素得電子、O元素失電子,生成氧氣失去電子物質的量等于Mn得到電子的物質的量,生成的錳酸鉀、二氧化錳都和濃鹽酸反應生成錳離子和氯氣,根據轉移電子相等知,Mn元素得到電子的物質的量等于生成氯氣失去電子的物質的量,則整個反應過程中高錳酸鉀中Mn元素得到電子的物質的量等于生成氧氣、氯氣失去電子的物質的量之和,據此計算生成氯氣體積.
解答 解:(1)①MnOOH中O元素化合價為-2價、H元素化合價為+1價,該化學式中各元素化合價的代數和為1確定Mn的化合價為+3;主族元素原子核外電子層數與其周期數相同,最外層電子數與其族序數相等,O原子核外有3個電子層、最外層電子數是6,所以O元素位于第二周期第VIA族,
故答案為:+3;二;VIA;
②設生成MnO2的物質的量為x,
2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2固體質量減少
2mol 56g
x 2.8g
2mol:56g=x:2.8g
x=$\frac{2mol×2.8g}{56g}$=0.1mol,
故答案為:0.1mol;
(2)碳酸錳礦主要成分為MnCO3、MnO2、FeCO3、SiO2、Al2O3,將碳酸錳礦中加入稍過量的稀硫酸,MnCO3、FeCO3、Al2O3和稀硫酸反應分別生成MnSO4、FeSO4、Al2(SO4)3,MnO2氧化性大于Fe3+,則MnO2和Fe2+在酸性條件下發生反應MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,SiO2不反應,過濾后,濾渣成分為SiO2,濾液乙中含有MnSO4、Al2(SO4)3、Fe2(SO4)3,向濾液乙中加入過量雙氧水,然后加入碳酸氫銨調節溶液的pH,過濾得到沉淀Al(OH)3、Fe(OH)3,濾液中溶質為MnSO4,
①反應物接觸面積越大,反應速率越快,將含雜質的碳酸錳礦使用前需將其粉碎,增大反應物接觸面積,反應速率加快,
故答案為:增大接觸面積,加快反應速率;
②在濾液乙中錳元素只以Mn2十的形式存在,且濾渣甲中不含MnO2,則濾渣甲的主要成分是不溶于稀硫酸的SiO2;
酸性條件下,二氧化錳和亞鐵離子發生氧化還原反應生成錳離子、鐵離子和水,離子方程式為MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,
故答案為:SiO2;MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O;
③Fe3+完全沉淀時c(OH-)≥$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L、Al3+完全沉淀時c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L>$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L,鐵離子需要的pH較小,鋁離子需要的pH較大;如果使這兩種兩種都完全沉淀,則溶液中c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L,溶液的pH=-lg$\frac{1{0}^{-14}}{1{0}^{-9}}$=5,
故答案為:5;
(3)KMnO4分解時Mn元素得電子、O元素失電子,生成氧氣失去電子物質的量等于Mn得到電子的物質的量,生成的錳酸鉀、二氧化錳都和濃鹽酸反應生成錳離子和氯氣,根據轉移電子相等知,Mn元素得到電子的物質的量等于生成氯氣失去電子的物質的量,則整個反應過程中高錳酸鉀中Mn元素得到電子的物質的量等于生成氧氣、氯氣失去電子的物質的量之和,
設生成氯氣體積為V2L,根據轉移電子守恒得$\frac{{V}_{2}}{22.4}$mol×2+$\frac{{V}_{1}}{22.4}$mol×4=nmol×(7-2)
V=56n-2V1,故答案為:56n-2V1.
點評 本題考查物質制備,為高頻考點,側重考查學生閱讀、獲取信息、加工利用信息解答問題、計算及知識綜合應用能力,明確元素化合物性質、化學反應原理是解本題關鍵,涉及方程式的計算、溶度積常數計算、化學反應速率影響因素等知識點,難點是溶液pH的計算,注意(3)題轉移電子守恒的靈活應用,題目難點中等.


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:解答題
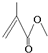 ,它的分子式為C5H8O2,存在的官能團有碳碳雙鍵和酯基,該物質能發生的反應類型有加成反應、氧化反應、水解反應.
,它的分子式為C5H8O2,存在的官能團有碳碳雙鍵和酯基,該物質能發生的反應類型有加成反應、氧化反應、水解反應.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某研究性學習小組模擬工業生產過程進行試驗.請回答下列問題:
某研究性學習小組模擬工業生產過程進行試驗.請回答下列問題:
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨反應需使用催化劑,說明催化劑可以促進該平衡向生成氨的方向移動 | |
| B. | 常溫下,用蒸餾水不斷稀釋醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值變小 | |
| C. | 反應SiO2(s)+3C(s)=SiC(s)+2CO(g)室溫下不能自發進行,則該反應的△H<0 | |
| D. | 對于Ca(OH)2的沉淀溶解平衡,升高溫度,Ca(OH)2的溶解速率增大,Ksp減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
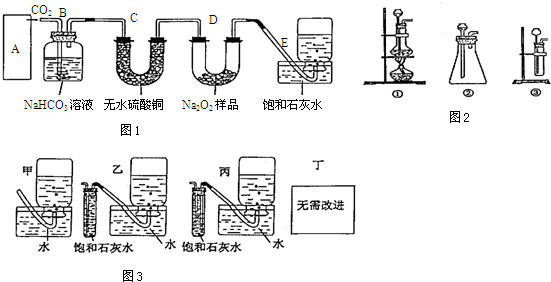
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
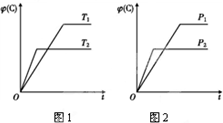 可逆反應m A(s)+n B(g)?e C(g)+f D(g),反應過程中,當其他條件不變時,C的體積分數φ(C)在不同溫度和不同壓強的條件下隨時間的變化如圖所示.下列敘述正確的是( )
可逆反應m A(s)+n B(g)?e C(g)+f D(g),反應過程中,當其他條件不變時,C的體積分數φ(C)在不同溫度和不同壓強的條件下隨時間的變化如圖所示.下列敘述正確的是( )| A. | 平衡后,若使用催化劑,C的體積分數將增大 | |
| B. | 平衡后,若溫度升高,化學平衡向正反應方向移動 | |
| C. | 平衡后,增加A的質量化學平衡向正反應方向移動 | |
| D. | 化學方程式中,化學計量數的關系為n<e+f |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com