
【題目】根據下列五種短周期元素的電離能數據(單位:kJ/mol),回答下面各題。
元素代號 | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
(1)在這五種元素中,最可能處于同一族的兩種元素是_________(填元素符號),S元素最可能是_____區元素
(2)基態Q元素原子的價電子排布式是____________。Q和T同周期。化合物QT中T元素的化合價為_______;第一電離能介于Q、T之間的同周期元素有______種。
(3)化合物RT3中化學鍵類型為_______,RT3的陰離子的幾何構型為________。
(4)下列元素中,化學性質和物理性質最像U元素的是_____________
A.硼 B.鈹 C.鋰 D.氦 E.碳
(5)R的某種氧化物X晶胞結構如圖所示,晶胞參數a=0.566 nm,X的化學式為_____;列式并計算晶體X的密度(g·cm-3)_____。

【答案】 B和Al p 2s22p1 -3 3 離子鍵、共價鍵 直線型 D Na2O ![]()
【解析】試題分析:本題考查電離能的分析和元素的推斷,價電子排布式的書寫,第一電離能大小的比較,離子幾何構型的判斷,晶胞的分析和計算。Q元素的I4![]() I3,Q元素的原子最外層有3個電子,Q處于IIIA;R元素的I2
I3,Q元素的原子最外層有3個電子,Q處于IIIA;R元素的I2![]() I1,R元素的原子最外層有1個電子,R處于IA;S元素的I4
I1,R元素的原子最外層有1個電子,R處于IA;S元素的I4![]() I3,S元素的原子最外層有3個電子,S處于IIIA;T、U元素的I1~I5沒有突變,T、U的最外層電子數至少5個。
I3,S元素的原子最外層有3個電子,S處于IIIA;T、U元素的I1~I5沒有突變,T、U的最外層電子數至少5個。
(1)根據上述分析,這五種元素中,最可能處于同一族的兩種元素是Q和S,Q和S都處于IIIA,Q的I1大于S的I1,Q為B元素,S為Al元素。最可能處于同一族的兩種元素是B和Al。S元素為Al元素,基態Al原子的核外電子排布式為1s22s22p63s23p1,最后一個電子填入3p能級,Al是p區元素。
(2)Q為B元素,B原子核外有5個電子,基態B原子核外電子排布式為1s22s22p1,基態B原子的價電子排布式為2s22p1。Q的化合價為+3價,根據化合物中元素的正負化合價代數和為0,QT中T元素的化合價為-3價。Q屬于第二周期,Q和T同周期,T也屬于第二周期,T為N元素,第一電離能介于B和N之間的有Be、C、O,共3種元素。
(3)R為IA族元素,R原子核外電子數大于5,R為Na元素;T為N元素,RT3為NaN3,其中含有離子鍵和共價鍵。NaN3中陰離子為N3-,N3-與CO2互為等電子體,CO2為直線型,則N3-也為直線型。
(4)U的最外層電子數至少5個,U不可能是IA族~IVA族元素,U的第一電離能較大,U可能是0族元素,化學性質和物理性質最像U元素的是氦,答案選D。
(5)用“均攤法”,小黑球(Na+):8個,大白球(O2-):8![]() +6
+6![]() =4,X的化學式為Na2O。晶胞的體積為(0.566nm)3=(0.566
=4,X的化學式為Na2O。晶胞的體積為(0.566nm)3=(0.566![]() 10-7)3cm3,1mol晶胞的體積為(0.566
10-7)3cm3,1mol晶胞的體積為(0.566![]() 10-7)3cm3
10-7)3cm3![]() NA,1mol晶胞的質量為4
NA,1mol晶胞的質量為4![]() 62g,晶體X的密度為
62g,晶體X的密度為![]() =2.27g/cm3。
=2.27g/cm3。


 靈星計算小達人系列答案
靈星計算小達人系列答案 孟建平錯題本系列答案
孟建平錯題本系列答案科目:高中化學 來源: 題型:
【題目】對化學反應的速率和限度的敘述正確的是( )
A.增加某一反應物的用量一定能夠加快該反應的速率
B.化學反應的限度是不可改變的
C.化學反應進行的時間越長該反應的限度越大
D.化學反應達到限度時,正逆反應速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下,m g氣體A與n g氣體B的分子數目一樣多,下列說法不正確的是( )
A. 在任意條件下,若兩種分子保持原組成,則其相對分子質量之比為m∶n
B. 25 ℃、1.25×105 Pa時,兩氣體的密度之比為n∶m
C. 同質量的A、B在非標準狀況下,其分子數之比為n∶m
D. 相同狀況下,同體積的氣體A與B的質量之比為m∶n
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種化學性質很活潑的非金屬單質,它具有較強的氧化性。下列敘述中不正確的是:
A. 紅熱的銅絲在氯氣中劇烈燃燒,生成棕黃色煙
B. 鈉在氯氣中燃燒,生成白色的煙
C. 純凈的氫氣在氯氣中安靜的燃燒,在集氣瓶口形成白色煙霧
D. 氯氣能與水反應生成鹽酸和次氯酸,次氯酸見光易分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鍺是重要的稀缺戰略資源,廣泛應用于眾多國防軍工及民用領域,屬于我國戰略收儲金屬。某科研課題采用的提取鍺技術路線為:低品位鍺精礦-(次亞磷酸鈉熱還原-真空揮發富集)-揮發產物高品位還原鍺精礦-堿氧化預處理-鹽酸蒸餾提純-高純四氯化鍺-高純二氧化鍺。

(1)在周期表中金屬與非金屬的分界處,可以找到半導體材料,如Si、 等,半導體器件的研制正是開始于 ,后來發展到研制與它同族的 。三種元素依次是_______(填標號)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)請配平次亞磷酸鈉熱還原反應的化學方程式并在括號內注明反應條件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位還原鍺精礦堿氧化預處理過程的產物是鍺酸鈉,請寫出該過程的化學反應方程式:____________________________________________
(4)高純二氧化鍺含量采用碘酸鉀滴定法進行分析。稱取3.600g高純二氧化鍺樣品,采用氫氧化鈉在電爐上溶樣,次亞磷酸鈉加熱還原,然后以淀粉為指示劑,用碘酸鉀標準溶液(0.6000mol/L)滴定,消耗的碘酸鉀體積為19.00mL。[20℃以下,次亞磷酸鈉不會被碘酸鉀和碘氧化]
①滴定終點的現象是_____________________________。
②此樣品中二氧化鍺含量是_________。(保留四位有效數字)
(5)用氫氣還原GeO2可制得金屬鍺。其反應如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反應式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),則還原反應的溫度一般控制在_________℃范圍內。[已知GeO在700℃會升華,T(K)=t(℃)+273]
(6)鍺在硝酸中的溶解速度受硝酸濃度、攪拌速度、溫度等因素影響。如圖,鍺溶解速度有一最大值,硝酸的濃度小于此值時,隨濃度增加溶解速度增加,反之降低,這是由于硝酸濃度高時_________加劇所致。
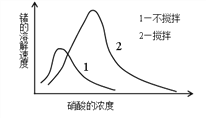
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示細胞內四種有機物的組成,請根據其生理功能分析回答:

(1)A是指____________;E在植物細胞內是指____________,在動物細胞內主要是指____________。
(2)F是指____________,其組成元素是____________。
(3)C的結構通式是____________,C形成G過程的反應叫____________。
(4)H是指____________,D是指____________。
(5)H和G共同組成細胞核內的重要物質____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com