
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| 時間/濃度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| 0.3mol/L |
| 2min |
| 5 |
| 4 |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |

| 時間/濃度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |

| 時間/濃度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | O |
| 第2min | 0.6 | a | O.2 |
| 第4min | O.3 | 0.975 | O.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | O.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 濃度 時間 |
c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.4 | 0 | 0 |
| 第2min | 3.2 | 1 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化學 來源:2011屆上海市盧灣區高三上學期期末考試化學試卷 題型:填空題
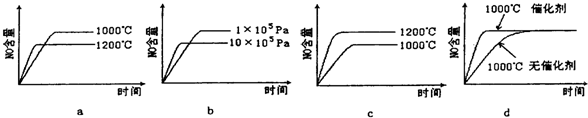
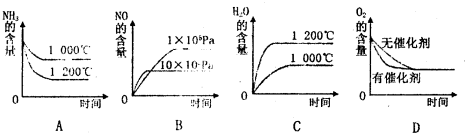
工業制硝酸的主要反應是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)該反應的平衡常數表達式為K=________________;升高溫度K值__________ (填“增大”、“減小”或“不變”)。
(2)若反應物起始的物質的量相同,下列關系圖錯誤的是________ (填字母序號)。
(3)在容積固定的密閉容器中發生上述反應,容器內部分物質的物質的量濃度如下表:
| 時間/濃度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com