
(10分)實驗室用18.4mol·L-1的濃硫酸來配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需儀器除了玻璃棒、燒杯、膠頭滴管 、量筒外,還需要哪個儀器才能完成該實驗,請寫出: 。
(2)計算所需濃硫酸的體積為________mL 。現有①10mL ②50mL ③100mL三種規格的量筒,應當選用___________。(填序號)
(3)實驗中兩次用到玻璃棒,其作用分別是:___________、__________。
(4)下列對容量瓶及其使用方法的描述中正確的是_____。
A.容量瓶上標有容積、溫度和濃度
B.容量瓶用蒸餾水洗凈后,必須烘干
C.配制溶液時,把量好的濃硫酸小心倒入容量瓶中,加入蒸餾水到接近刻度線
1~2 cm處,改用膠頭滴管加蒸餾水至刻度線
D.使用前要檢查容量瓶是否漏水
(5)在配制過程中,下列操作可引起所配溶液濃度偏低的有_______。(填序號)
①未洗滌稀釋濃硫酸時用過的燒杯和玻璃棒。
②未等稀釋后的硫酸溶液冷卻至室溫就轉移到容量瓶中。
③轉移前,容量瓶中含有少量蒸餾水。
④定容時,仰視刻度線。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:閱讀理解
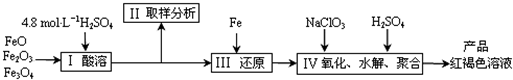
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
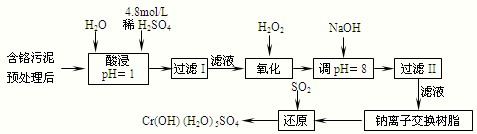
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
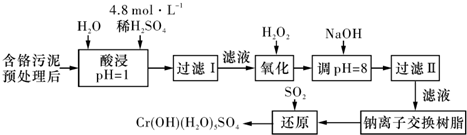
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | - | _ | 4.7 | - |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 開始沉淀時的pH | 2.7 | -- | -- | -- |
| 沉淀完全時的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com