
| 實驗 編號 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反應溫度 /℃ | 反應時間 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
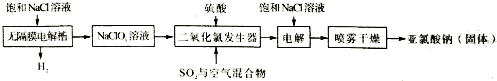
分析 (1)利用高錳酸鉀的顏色來判斷;
(2)實驗I和II研究濃度對反應速率的影響,溫度相同,濃度不同;實驗I和III研究溫度對反應速率的影響,濃度相同中,溫度不同;
(3)該反應中Mn元素化合價由+7價變為+2價、C元素化合價由+3價變為+4價,根據轉移電子守恒、原子守恒配平方程式;
(4)實驗I和實驗IV對比,其他條件相同,實驗IV加入MnSO4溶液后反應速率加快,應是催化劑對反應速率的影響;
(5)實驗結束后讀數前需要移動量氣管,使兩個量氣管的液面相平,使兩個量氣管的壓強相等.
解答 解:(1)實驗計時方法是從溶液混合開始記時,到紫紅色剛好褪去計時結束,故答案為:紫紅色剛好褪去;
(2)根據實驗目的,選擇合理數據:高錳酸鉀本身作為指示劑,濃度不變,都是2mL,V1=2mL,V3=2mL;實驗I和II研究濃度對反應速率的影響,用水來控制溶液的總體積相同,所以草酸體積V2=1mL;實驗I和III研究溫度對反應速率的影響,濃度全部相同,V4=2mL,V5=0mL,
故答案為:1;2;0;
(3)該反應中Mn元素化合價由+7價變為+2價、C元素化合價由+3價變為+4價,其轉移電子總數為10,根據轉移電子守恒知,KMnO4的計量數是2、H2C2O4的計量數是5,再根據原子守恒得方程式為2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O,
故答案為:2;5;3;1;2;10;8;
(4)從實驗數據分析,實驗I和實驗IV對比,其他條件相同,實驗IV加入MnSO4后反應速率加快,所以MnSO4溶液在反應中為催化劑,MnSO4是反應產物,開始濃度小,影響不大,隨著反應進行,濃度增大,催化效果明顯,
故答案為:MnSO4是反應產物,開始濃度小,影響不大,隨著反應進行,濃度增大,催化效果明顯;
(5)實驗結束后讀數前需要移動量氣管,使兩個量氣管的液面相平,其作用是使兩個量氣管的壓強相等,避免產生壓強差,影響測定結果,
故答案為:移動量氣管,使兩個量氣管的液面相平.
點評 本題考查影響化學反應速率的因素、氧化還原反應的配平,需要認真分析題中信息,得出合理結論,本題難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 已知某醇燃料含有碳、氫、氧三種元素.為了測定這種燃料中碳和氫兩種元素的質量比,可將氣態燃料放入足量的氧氣中燃燒,并使產生的氣體全部通入如圖所示的裝置,得到如表所列的實驗結果(假設產生的氣體完全被吸收):
已知某醇燃料含有碳、氫、氧三種元素.為了測定這種燃料中碳和氫兩種元素的質量比,可將氣態燃料放入足量的氧氣中燃燒,并使產生的氣體全部通入如圖所示的裝置,得到如表所列的實驗結果(假設產生的氣體完全被吸收):| 實驗前 | 實驗后 | |
| (干燥劑+U形管)的質量 | 101.1g | 102.9g |
| (石灰水+廣口瓶)的質量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 方案 | 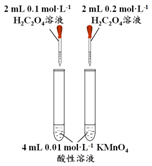 | 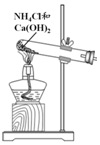 | 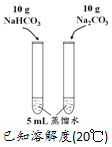 NaHCO3:9.6 g Na2CO3:21.8 g | 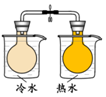 將NO2球浸泡在冷水和熱水中 |
| 目的 | 探究濃度對化學反應速率的影響 | 制備氨氣 | 室溫下比較NaHCO3和Na2CO3的溶解度 | 探究溫度對化學平衡的影響 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 126C和146C是2種核素,他們互稱同位素 | |
| B. | 近期化學研究者開發出被稱為第五形態的固體碳,這種新的碳結構稱作“納米泡沫”,它外形類似海綿,比重極小,并具有磁性.納米泡沫碳與C60互稱同素異形體 | |
| C. |  與 與 互為同分異構體 互為同分異構體 | |
| D. | 硝基苯可看成是由  和-NO2兩種基團組成 和-NO2兩種基團組成 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com