
下列根據實驗操作和實驗現象所得出的結論,正確的是
A | 向2ml2%的CuSO4溶液中加入0.5ml 1%的NaOH溶液,振蕩后滴加幾滴M溶液,加熱 | 未出現磚紅色沉淀 | M中不含醛基 |
B | 在CuSO4溶液中加入KI溶液,再加入苯,振蕩后靜置 | 有白色沉淀生成,苯層呈紫紅色 | 白色沉淀可能為CuI |
C | 向有機試劑N中加入2mL5%的NaOH溶液,加熱,冷卻后取上層溶液滴加幾滴AgNO3溶液 | 出現褐色沉淀 | N不是鹵代烴 |
D | 將Fe(NO3)2樣品溶于稀H2SO4后,滴加KSCN溶液 | 溶液變為血紅色 | Fe(NO3)2樣品已氧化變質 |
 優質課堂快樂成長系列答案
優質課堂快樂成長系列答案科目:高中化學 來源:2017屆江蘇省淮安市高三12月考試化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖所示。下列說法不正確的是
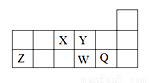
A. 元素W的最高價氧化物對應水化物的酸性比Q的強
B. 離子半徑的大小順序為:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
C. 元素X的氫化物與Q的氫化物化合的產物中既含共價鍵又含離子鍵
D. X、Z、W、Q四種元素的最高價氧化物對應水化物均能與強堿反應
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省高三上模擬四化學試卷(解析版) 題型:填空題
為了減少CO對大氣的污染,某研究性學習小組擬研究CO和H2O反應轉化為綠色能源H2。已知:
2CO(g)+O2(g)=2CO2(g);ΔH=—566kJ·moL-1
2H 2(g)+O2(g)=2H2O(g);ΔH=—483.6KJ·moL-1
2(g)+O2(g)=2H2O(g);ΔH=—483.6KJ·moL-1
H2O(g)=H2O(l);ΔH =—44.0KJ·moL-1
=—44.0KJ·moL-1
(1)表示氫氣燃燒熱的化學方程式中ΔH= ;
(2)寫出CO和H2O(g)作用生成CO2和H2的熱化學方程式  。
。
(3)往 1L體積不變的容器中加入0.200mol CO和1.00mol H2O(g),在t℃時反應并達到平衡,若該反應的化學平衡常數K=1(方程式中各 物質前化學計量數為最簡比),則t℃
物質前化學計量數為最簡比),則t℃ 時CO 的轉化率為 ;反應達到平衡后,升高溫度,此時平衡常數將 (填“變大”、“不變”或“變小”),平衡將向 (填“正”或“逆”)方向移動。
時CO 的轉化率為 ;反應達到平衡后,升高溫度,此時平衡常數將 (填“變大”、“不變”或“變小”),平衡將向 (填“正”或“逆”)方向移動。
(4)H2是一種理想的綠色能源,可作燃料電池;若該氫氧燃料電池以KOH為電解質溶液,其負極的電極反應式是 。
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省高三11月階段測化學卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是
A.已知電離常數H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11。H2SO3溶液和NaHCO3溶液反應:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O
B.控制pH為9~10,用NaClO溶液將NaCN廢水中的CN-氧化為兩種無污染的氣體:
2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
C.已知硫酸鉛難溶于水,也難溶于硝酸,卻可溶于醋酸銨溶液中,形成無色溶液。當Pb (CH3COO)2溶液中通入H2S氣體時有黑色 沉淀生成:Pb2++ S2-=PbS↓
沉淀生成:Pb2++ S2-=PbS↓
D.CuSO4溶液與過量濃氨水反應:Cu2++4NH3·H2O=[Cu (NH3)4]2++4H2O
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上周考五化學試卷(解析版) 題型:實驗題
石墨在材料領域有重要應用。某初級石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等雜質。設計的提純和綜合應用流程如下:
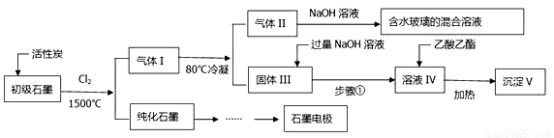
(注:SiCl4的沸點是57.6ºC,金屬氯化物的沸點均高于150ºC)
(1)已知1mol石墨完全轉化為金剛石需要吸收1.9kJ的能量。請寫出石墨轉化為金剛石的熱化學反應方程式: _________________________。
(2)①向反應器中通入Cl2前,需通一段時間的N2。高溫反應后,石墨中的氧化物雜質均轉變為相應氯化物。80℃冷凝的目的是:_____________________。②由活性炭得到氣體Ⅱ的化學反應方程式為:_____________________。
(3)加入過量NaOH溶液得到溶液IV的離子反應方程式為:_________________________。
(4)用化學反應原理解釋得到沉淀V的過程中乙酸乙酯和加熱的作用:________。1kg初級石墨最多可獲得V的質量為_______________kg。
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上五調考試化學卷(解析版) 題型:填空題
【化學——選修3:物質結構與性質】T、W、X、Y、Z是元素周期表前四周期中的常見元素,原子序數依次增大,相關信息如下表。
元索 | 相關信息 |
T | T元素可形成自然界硬度最大的單質 |
W | W與T同周期,核外有一個未成對電子 |
X | X原子的第一離能至第四電離能分別I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
Y | 常溫常壓下,Y單質是固體,其氧化物是形成酸雨的主要物質 |
Z | Z的一種同位素的質量數為63,中子數為34 |
(1) TY2是一種常用的溶劑,是__________(填“極性分子”或“非極性分子”),分子中存在________個σ鍵。
(2)W的最簡單氫化物容易液化,理由是__________,.放熱419 kJ,該反應的熱化學方程式為 __________。
(3)基態Y原子中,電子占據的最高能層符號為__________,該能層具有的原子軌道數為_____________、電子數為_________。Y、氧、W元素的第一電離能由大到小的順序為_________(用元素符號作答)。
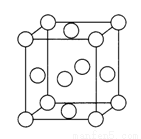
(4)已知Z的晶胞結構如圖所示,又知Z的密度為9.00 g/cm3,則晶胞邊長為___________cm;ZYO4常作電鍍液,其中ZYO42-的空間構型是__________,其中Y原子的雜化軌道類型是___________。元素Z與人體分泌物中的鹽酸以及空氣反應可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不僅是一種弱酸而且也是一種自由基,具有極高的活性。下列說法或表示正確的是
A.O2是氧化劑
B.HO2是氧化產物
C.HO2在堿中能穩定存在
D.1 mol Z參加反應有1 mol電子發生轉移
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上五調考試化學卷(解析版) 題型:選擇題
下列有關實驗的說法不正確的是( )
A.容量瓶、量筒和滴定管上都標有使用溫度,量筒、容量瓶都無“0”刻度,滴定管有“0”刻度;使用時滴定管水洗后還需潤洗,但容量瓶水洗后不用潤洗
B.在4 mL0.1 mol/L的K2Cr2O7溶液中滴加數滴1 mol/L的NaOH溶液,溶液顏色從橙色變成黃色
C.探究化學反應的限度:取5 mL 0.1 mol/LKI溶液,滴加0.1 mol/LFeCl3溶液5~6滴,充分反應,可根據溶液中既含I2又含I-的實驗事實判斷該反應是可逆反應
D.將含有少量氯化鉀的硝酸鉀放入燒杯中,加水溶解并加熱、攪拌,當溶液表面出現一層晶膜時停止加熱,冷卻結晶、過濾即可得到大量硝酸鉀晶體
查看答案和解析>>
科目:高中化學 來源:2017屆西藏林芝一中高三上月考四化學試卷(解析版) 題型:選擇題
下列儀器和裝置,用橡膠管經過簡單連接,可制備收集多種不同的氣體(暫不考慮尾氣吸收)。關于這些裝置的連接,下列說法正確的是

A.制備收集Cl 2:連接a→d→f B.制備收集NO2,連接a→c→f
2:連接a→d→f B.制備收集NO2,連接a→c→f
C.制備收集H2S,連接b→c→e D.制備收集NH3,連接b→d→e
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com