
【題目】POCl3常用作半導體摻雜劑及光導纖維原料,實驗室制備POCl3并測定產品含量的實驗過程如下:
I.制備PCl3
(1)實驗室用高錳酸鉀和濃鹽酸反應制氯氣。發生裝置可以是圖中的____(填字母代號)。
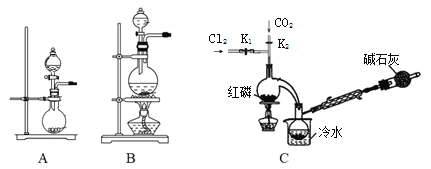
(2)檢查裝置C氣密性并裝入藥品后,先關閉K1,打開K2通入干燥的CO2,一段時間后,關閉K2,加熱曲頸瓶同時打開K1通入干燥氯氣,反應立即進行。圖中堿石灰的作用是______________。
II.實驗室制備POCl3。
采用氧氣氧化液態PCl3法制取POCl3,實驗裝置(加熱及夾持儀器略)如圖:
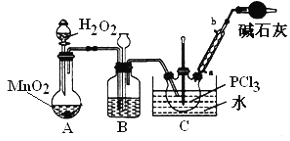
資料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相關信息如下表:
物質 | 熔點/℃ | 沸點/℃ | 相對分子質量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 兩者互溶,均為無色液體,遇水均劇烈反應生成含氧酸和氯化氫 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮濕空氣中會劇烈“發煙”,反應的化學方程式為___________________________________。
(4)反應溫度要控制在60~65℃,原因是:_________________________________。
(5)通過佛爾哈德法可以測定產品中Cl元素含量,實驗步驟如下:
a、準確稱取15.0 g POCl3產品,置于盛有60.00 mL蒸餾水的水解瓶中搖動至完全水解,將水解液配成100.00 mL溶液。
b、取10.00 mL溶液于錐形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3標準溶液。
c、加入少許硝基苯用力搖動,使沉淀表面被有機物覆蓋。
d、以NH4Fe (SO4) 2為指示劑,用0.2 molL﹣1 NH4SCN溶液滴定過量的AgNO3溶液,達到滴定終點時共用去l0.00 mL NH4SCN溶液。
①步驟d中達到滴定終點的現象是__________________________________________。
②產品中Cl元素的質量分數為______________(保留3位有效數字)。
【答案】A 吸收尾氣,并防止空氣中的水蒸氣進入蒸餾燒瓶 POCl3+3H2O=H3PO4+3HCl 溫度過低,反應速度太慢,溫度過高,PCl3易揮發,利用率低 溶液由無色變為紅色且30 s內不再變色 71.0%
【解析】
I.(1)高錳酸鉀和濃鹽酸反應制氯氣,屬于固體和液體反應,反應不需要加熱,據此選擇裝置;
(2)根據氯氣有毒,產品PCl3遇水均劇烈反應生成含氧酸和氯化氫進行分析;
II.實驗室制備POCl3。A裝置中用雙氧水與二氧化錳反應生成氧氣,通過加入雙氧水的量,可以控制產生氧氣的速率,氧氣中含有水蒸氣用濃硫酸除去,所以B裝置中裝濃硫酸,裝置B中有長頸漏斗,可以平衡裝置內外的壓強,起安全瓶的作用,純凈的氧氣與三氯化磷反應生成POCl3,為了控制反應速率且要防止三氯化磷揮發,反應的溫度控制在60~65℃,所以裝置C中用水浴,為防止POCl3揮發,用冷凝管進行冷凝回流,POCl3遇水均劇烈水解為含氧酸和氯化氫,所以為防止空氣中水蒸汽進入裝置,同時吸收尾氣,所以在裝置的最后連有堿石灰的干燥管,據此分析回答問題。
I.(1)固體和液體反應,反應不需要加熱,據此選擇裝置A;
答案:A;
(2)根據氯氣有毒,因此尾氣不可排放到空氣中,產品PCl3遇水劇烈反應,要防止空氣中的水蒸氣進入蒸餾燒瓶;
答案:吸收尾氣,并防止空氣中的水蒸氣進入蒸餾燒瓶;
II.(3)POCl3在潮濕空氣中會劇烈“發煙”,確定有HCl生成,根據磷元素的化合價還可以確定有磷酸生成,方程式為POCl3+3H2O=H3PO4+3HCl;
答案:POCl3+3H2O=H3PO4+3HCl ;
(4)根據上面的分析可知,反應溫度應控制在60~65℃,原因是溫度過低,反應速率小,溫度過高,三氯化磷會揮發,利用率低;
答案:溫度過低,反應速度太慢,溫度過高,PCl3易揮發,利用率低 ;
(5)因為Fe3+與SCN-結合,溶液會變紅,因此以NH4Fe (SO4) 2為指示劑,用0.2 molL﹣1 NH4SCN溶液滴定過量的AgNO3溶液,達到滴定終點的現象是溶液由無色變為紅色且30 s內不再變色;
答案:溶液由無色變為紅色且30 s內不再變色;
(6)測定POCl3產品含量,用POCl3與水反應生成氯化氫,然后用硝酸銀標準溶液沉淀溶液中的氯離子,NH4SCN溶液滴定過量的AgNO3溶液,根據NH4SCN的物質的量可計算出溶液中剩余的AgNO3,結合AgNO3的總物質的量得知與氯離子反應的硝酸銀,進而計算出溶液中氯離子的物質的量,進而確定氯元素的質量分數;NH4SCN的物質的量為0.2mol/L×0.01L=0.002mol,根據反應Ag++SCN-=AgSCN↓,可知溶液中剩余的銀離子的物質的量為0.002mol,POCl3與水反應生成氯化氫的物質的量為(3.2×0.01mol-0.002mol)×10=0.3mol,氯元素的質量分數為![]() ×100%=71.0%;
×100%=71.0%;
答案:71.0%。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】電動公交車替代燃油公交車是節能減排、控制霧霾的重要舉措之一,下圖所示電池是一種正在開發的車載電池。有關該電池的說法正確的是
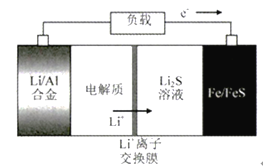
A. 放電時Fe/FeS極是負極
B. 放電時負極反應式為:Al-3e-=Al3+
C. 充電時陽極反應式為:Fe+S2--2e-=FeS
D. 左邊電解質可以是LiOH的醇溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.W、X、Y、Z是原子序數依次增大的同一短周期元素,W、X是金屬元素,Y、Z是非金屬元素。
(1)W、X的最高價氧化物對應的水化物可以反應生成鹽和水,該反應的離子方程式為_______________________________________________。
(2)W與Y可形成化合物W2Y,該化合物的電子式為_______________。
II.A、B、C、D均為中學化學常見的純凈物,A是單質。
它們之間有如下的反應關系:
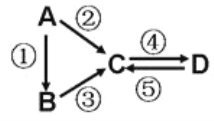
(3)若A是淡黃色單質固體,C、D是氧化物,且C是造成酸雨的主要物質。則C與另一種淡黃色物質反應的化學方程式______________________________________。
(4)若D物質具有兩性,②③反應均要用強堿溶液,④反應是通入過量的一種引起溫室效應的主要氣體。判斷單質A的元素在周期表中的位置是________________。
(5)若A是應用最廣泛的金屬。④反應用到A,②⑤反應均用到同一種非金屬單質。C的溶液用于蝕刻印刷銅電路板,寫該反應的離子方程式________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】油酸甘油酯和硬脂酸甘油酯均是天然油脂的成分。 它們的結構簡式如下圖所示。
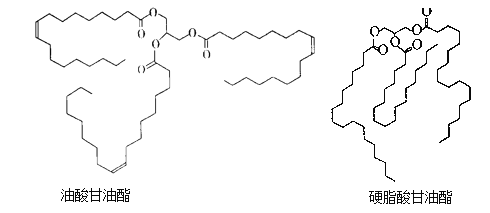
下列說法錯誤的是
A. 油酸的分子式為C18H34O2
B. 硬脂酸甘油酯的一氯代物共有54種
C. 天然油脂都能在NaOH溶液中發生取代反應
D. 將油酸甘油酯氫化為硬脂酸甘油酯可延長保存時間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一塊11.0 g的鐵鋁合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中無Fe2+存在,加熱除去多余的H2O2,當加入200 mL 6 molL﹣1NaOH溶液時沉淀量最多,且所得沉淀質量為26.3 g,下列說法不正確的是
A.該合金中鐵的質量為5.6 g
B.合金與稀硫酸反應共生成0.45 mol H2
C.該合金與足量氫氧化鈉反應,轉移的電子數為0.6 NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列敘述正確的是( )
A. 17 g羥基(—OH)所含有的電子數是10NA個
B. 1 mol苯乙烯中含有的碳碳雙鍵數為4NA個
C. 常溫下,14 g乙烯和丙烯的混合物中總原子數為3NA個
D. 4.2 g C3H6中含有的碳碳雙鍵數一定為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖所示的有機物X可生產S-誘抗素Y。下列說法正確的是( )
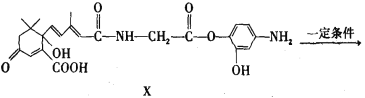
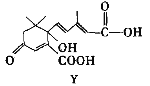
A. X可以發生氧化、取代、酯化、加聚、縮聚反應,并能與鹽酸反應生成有機鹽
B. Y既可以與FeCl3溶液發生顯色反應,又可使酸性KMnO4溶液褪色
C. 1mol X與足量NaOH溶液反應,最多消耗4mol NaOH
D. 有機物分子中若某一個碳原子連接4個不同的原子或基團,這種碳原子稱為“手性碳原子”,則在X結構中有2個手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z是原子序數依次增大的同一短周期元素,W、X是金屬元素,Y、Z是非金屬元素。
(1)W和X的最高價氧化物的水化物之間可以相互反應生鹽和水,該反應的離子方程式為___。
(2)W與Y可形成化合物W2Y,該化合物的電子式為___。
(3)比較Y、Z氣態氫化物的穩定性 > (用化學式表示)___。
(4)Y的低價氧化物通入Z單質的水溶液中,發生反應的化學方程式為___。
(5)W、X、Y、Z四種元素簡單離子的離子半徑由大到小的順序是: > > > (用離子符號表示)___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題
(1)① 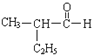 系統命名為______,與銀氨溶液反應的化學方程式為__________
系統命名為______,與銀氨溶液反應的化學方程式為__________
②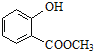 中含有的官能團的名稱為_____.
中含有的官能團的名稱為_____.
(2)戊基有_____種結構,請寫出其中的核磁共振氫譜有二個吸收峰的結構簡式______.
(3)糖類、油脂、蛋白質都是人體必需的營養物質。下列物質中①葡萄糖②麥芽糖③蔗糖④纖維素⑤淀粉,互為同分異構體的是___;具有還原性,能發生銀鏡反應的是___.(填序號)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com