
【題目】1.52g 銅鎂合金完全溶解于50mL 密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀。下列說法不正確的是( )。
A. 該合金中銅與鎂的物質的量之比是2:1
B. 該濃硝酸中HNO3的物質的量濃度是14.0 mol/L
C. NO2和N2O4的混合氣體中,NO2的體積分數是80%
D. 得到2.54 g沉淀時,加入NaOH溶液的體積是600 mL
【答案】D
【解析】設合金中Cu、Mg的物質的量分別為x、y,根據題目所給信息知64x+24y=1.52①;在反應過程中有:Cu-2e-=Cu2+、Mg-2e-=Mg2+,Cu2++2OH-=Cu(OH)2↓、Mg2++2OH-=Mg(OH)2↓,所以金屬失去電子的物質的量等于金屬陽離子完全沉淀所需OH-的物質的量,n(OH-)=![]() =0.06mol,故2x+2y=0.06②,由①和②組成方程組解得x=0.02 mol,y=0.01 mol。A項,由上述計算可得,銅與鎂的物質的量之比是2∶1,A正確;B項,根據c=
=0.06mol,故2x+2y=0.06②,由①和②組成方程組解得x=0.02 mol,y=0.01 mol。A項,由上述計算可得,銅與鎂的物質的量之比是2∶1,A正確;B項,根據c=![]() 可得:c(HNO3)=
可得:c(HNO3)= ![]() molL-1=14.0 mol·L-1,B正確;由上述分析可知,Cu、Mg共失去0.06 mol電子,根據得失電子守恒,硝酸完全被還原為NO2,則NO2的物質的量應為0.06 mol,已知得到混合氣體1 120 mL(標準狀況),即0.05 mol混合氣體,是因為存在2NO2
molL-1=14.0 mol·L-1,B正確;由上述分析可知,Cu、Mg共失去0.06 mol電子,根據得失電子守恒,硝酸完全被還原為NO2,則NO2的物質的量應為0.06 mol,已知得到混合氣體1 120 mL(標準狀況),即0.05 mol混合氣體,是因為存在2NO2![]() N2O4,可求得N2O4為0.01 mol,NO2為0.04 mol,故C正確;D項,得到2.54 g沉淀時,消耗0.06 mol NaOH(濃度為1.0 mol·L-1),體積為60 mL,故D錯誤。
N2O4,可求得N2O4為0.01 mol,NO2為0.04 mol,故C正確;D項,得到2.54 g沉淀時,消耗0.06 mol NaOH(濃度為1.0 mol·L-1),體積為60 mL,故D錯誤。


科目:高中化學 來源: 題型:
【題目】氫氣是清潔的能源,也是重要的化工原料,根據以下兩種制氫方法。完成下列問題:
(1)方法一:H2S熱分解法,反應式為:2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密閉容器中,測定H2S分解的轉化率(H2S的起始濃度均為cmol/L),測定結果見右圖,圖中曲線a表示H2S的平衡轉化率與溫度關系,曲線表示不同溫度下反應經過相同時間未達到化學平衡時H2S的轉化率。

①△H______0,(“>”、“<”或“=”),
②若985℃時,反應經tmin達到平衡,此時H2S的轉化率為40%,則tmin內反應速率v(H2)=______(用含c、t的代數式表示)。
③請說明隨溫度的升高,曲線b向曲線a接近的原因:______。
(2)方法二:以CaO為吸收體,將生物材質(以C計)與水蒸氣反應制取H2.相關主要反應如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①計算反應C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分別為反應I、Ⅱ、Ⅲ的平衡常數,該平衡常數K=_____________(用K1、K2、K3表示)。
②對于可逆反應C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2產率的是______。(填字母編號)
CaCO3(s)+2H2(g),采取以下措施可以提高H2產率的是______。(填字母編號)
A.降低體系的溫度
B.壓縮容器的體積
C.適當增加水蒸氣的通入量
D.增加CaO的量
③下圖為反應I在一定溫度下,平衡時各氣體體積百分含量隨壓強變化的關系圖。若反應達某一平衡狀態(tài)時,測得c(H2O)=2c(H2)=2c(CO)=2mol/L,試根據H2O的體積百分含量變化曲線,補充完整CO的變化曲線示意圖。
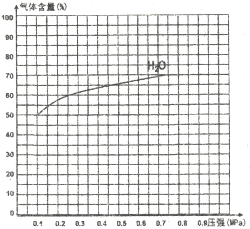
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀是中學化學常用的強氧化劑,實驗室中可通過以下反應制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相關物質的溶解度數據見下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液顯綠色,KMnO4溶液顯紫紅色。實驗流程如下:

請回答:
(1)步驟①應在 中熔化,并用鐵棒用力攪拌,以防結塊。
A.燒杯 B.蒸發(fā)皿 C.瓷坩堝 D.鐵坩堝
(2)①綜合相關物質的化學性質及溶解度,步驟③中可以替代CO2的試劑是 。
A.二氧化硫 B.稀醋酸 C.稀鹽酸 D.稀硫酸
②當溶液pH值達10~11時,停止通CO2;若CO2過多,造成的后果是 。
(3)烘干時,溫度控制在80℃為宜,理由是 。
(4)工業(yè)上采用電解K2MnO4水溶液的方法來生產KMnO4,其中隋性電極作陽極,鐵作陰極。請寫出陽極的電極反應式 ,與原方法相比,電解法的優(yōu)勢為 。
(5)通過用草酸滴定KMnO4溶液的方法可測定KMnO4粗品的純度(質量分數)。
①量取KMnO4溶液應選用 (填“酸式”或“堿式”)滴定管;若量取KMnO4溶液的滴定管用蒸餾水洗凈后未潤洗,則最終測定結果將 (填“偏大”、“偏小”或“不變”)。
②滴定過程中反應的離子方程式為______。(已知:常溫下0.01 mol/L的H2C2O4溶液的pH為2.1)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰錳電池的體積小、性能優(yōu)良,是常用的一次電池。該電池反應原理如圖所示,其中電解質LiCIO4。溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2。

回答下列問題:
(1)外電路的電流方向是由____極流向____極。(填字母)
(2)電池正極反應式為__ __。
(3)是否可用水代替電池中的混合有機溶劑?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可與KOH和KClO3,在高溫下反應,生成K2MnO4,反應的化學方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分。請回答下列問題:

(1)上述元素中,屬于s區(qū)的是________________________(填元素符號)。
(2)寫出元素⑩的基態(tài)原子的電子排布式___________________________。
(3)元素第一電離能為⑤____________⑨(填“大于”或“小于”)。
(4)元素③氣態(tài)氫化物的中心原子有___________對弧對電子,其VSEPR模型為_________________;中心原子的雜化類型為_______________;該分子為_________________分子(填“極性”或“非極性”)。向AgNO3溶液中逐滴加入其水溶液,可觀察到的現象為___________ ___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用含銅、鐵的粗鋅制備硫酸鋅及相關物質。工藝流程圖及有關數據如下:

物質 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
請回答下列問題:
(1)粗鋅中的銅與混酸的稀溶液反應的化學方程式為__________________________,圖中處理氣體X要能夠體現綠色化學思想,還需補充氣體______(填化學式)。
(2)若溶液I中c(Cu2+)為0.05mol·L-1,則溶液II中c(Fe3+)>____mol·L-1。
(3)若固體A是Zn,取9.61 g固體C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到標準狀況下2.24L的氣體,向所得溶液中加入2 mol·L-1NaOH溶液,則當生成沉淀最多時,沉淀的質量為_____g;若固體A是另一種物質,取部分固體C于試管中,加入鹽酸產生有臭雞蛋味氣體,則該反應的離子方程式為________________________。
(4)溶液Ⅲ經過蒸發(fā)濃縮、____________、過濾、洗滌、干燥,即得到較純凈的硫酸鋅晶體;溶液還可以制備ZnS,實際選擇的是(NH4)2S溶液而不是Na2S溶液作為反應物,理由是后者制得的ZnS含有較多的雜質,則該雜質是____________(填化學式)。
(5)金屬鋅常用作酸性干電池的負極,干電池不使用時,由于負極與電解質溶液接觸而發(fā)生自放電反應:2NH4++Zn=2NH3+H2↑+Zn2+,造成電量自動減少。寫出鉛蓄電池不使用時,其正極上發(fā)生自放電的化學方程式__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I、某研究性學習小組為了驗證CH4是否具有還原性,設計了如下實驗:

(1)實驗過程中觀察到無水CuSO4逐漸變藍,澄清石灰水出現渾濁現象,則CH4與CuO反應的化學方程式為____ __ 。
(2)研究小組將CH4通入溴水時,發(fā)現溴水逐漸褪色,你認為原因可能是____ 。
請設計一個實驗方案證明你的結論(用文字表示,不必畫實驗裝置圖)___ _____________ 。
II、(1)工業(yè)上用電石-乙炔生產氯乙烯的反應如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
電石-乙炔法的優(yōu)點是流程簡單,產品純度高,而且不依賴與石油資源。
電石-乙炔法的缺點是: 、 。
(2)乙烷和氯氣反應可制得ClCH2CH2Cl,ClCH2CH2Cl加熱分解得到氯乙烯和氯化氫。請設計以乙烯和氯氣為原料制取氯乙烯的方案(其他原料自選),用化學方程式表示(不必注明反應條件)。要求:①反應產生的氯化氫必須用于氯乙烯的制備;②不再產生其他廢液。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組,擬探究和比較SO2和C12的漂白性,設計如下圖所示的實驗裝置二套。請你參與探究并回答下列問題。

(1)向第一套裝置中通入一段時間的SO2,觀察到試管中的品紅溶液 (填“能”或“不能” )褪色,然后再加熱試管,溶液 (填“恢復”或“不恢復”)紅色;
(2)向第二套裝置中通入一段時間的C12,觀察到試管中的品紅溶液也褪色,然后再加熱試管,溶液 (填“恢復”或“不恢復”)紅色;
(3)由以上兩個實驗可以說明SO2和C12的漂白原理 (填“相同”或“不相同”);
(4) C12通入品紅溶液中,生成的具有漂白性的物質是 (填“HC1”或“HClO”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25攝氏度時,現有濃度均為0.10 mol/L的四種溶液:①氨水 ② NaOH溶液 ③CH3COOH溶液 ④鹽酸。請回答:
(1)①溶液中c(H+) c(OH-) (填“>”、“<”或“=”)。
(2)醋酸的電離方程式是 。
(3)①對水的電離平衡產生的影響是 ,理由是 。
(4)溶液②和溶液③等體積混合后所得溶液顯堿性,原因是 (用離子方程式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com