
為測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現稱取該樣品4份,分別加入相同濃度的NaOH溶液各40.00 mL,加熱至120 ℃左右,使氨氣全部逸出〔(NH4)2SO4和NH4HSO4固體分解的溫度均高于200 ℃〕,測得有關實驗數據如下:(標準狀況下)
實驗序號 | 樣品的質量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)實驗過程中有關反應的離子方程式為_________________________________________。
(2)由Ⅰ組數據直接推測:標準狀況下3.7 g 樣品進行同樣實驗時,生成氨氣的體積為__________L。
(3)試計算該混合物中(NH4)2SO4和NH4HSO4的物質的量之比為__________________。
(4)欲計算該NaOH溶液的物質的量濃度應該選擇__________組數據,由此求得NaOH溶液的物質的量濃度為________________。
解析:(1)(NH4)2SO4和NH4HSO4在溶液中是完全電離的,所以(NH4)2SO4和NH4HSO4固體混合物中加入NaOH溶液時,將有以下兩個離子反應發生H++OH-![]() H2O,
H2O,![]() +OH-
+OH-![]() NH3↑+H2O。
NH3↑+H2O。
(2)由表中數據可看出,當樣品質量由7.4 g增加到14.8 g時,釋放出的氣體體積由1.68 L增加到3.36 L,是成比例增加的,說明NaOH溶液此時是足量的。所以可推斷出當樣品的質量為3.7 g時,所釋放出的氣體體積應為1.68 L/2=0.84 L。
(3)設I組混合物中(NH4)2SO4的物質的量為x mol,NH4HSO4的物質的量為y mol,依據表中的數據有:當混合物質量為14.8 g時,產生氣體NH3的物質的量為3.36 L/22.4 L·mol-1=0.15 mol。
(NH4)2SO4—2NH3 NH4HSO4—NH3
x mol 2x mol y mol y mol
![]() 解此方程組得到:x=0.025,y=0.1。
解此方程組得到:x=0.025,y=0.1。
所以,混合物中(NH4)2SO4和NH4HSO4的物質的量之比為0.025∶0.1=1∶4。
(4)分析表中數據,當加入樣品質量為22.2 g時,放出的氣體體積不再與樣品質量成比例,說明此時NaOH的量不足,但可以判斷出,此時的NaOH消耗完了全部的H+,并消耗了部分的![]() 。當加入樣品為37.0 g時,無氣體釋放,這表明此時NaOH全部被溶液中的H+消耗。計算該NaOH溶液的物質的量濃度應該選擇Ⅲ組數據進行計算。
。當加入樣品為37.0 g時,無氣體釋放,這表明此時NaOH全部被溶液中的H+消耗。計算該NaOH溶液的物質的量濃度應該選擇Ⅲ組數據進行計算。
結合(3)的計算結果可知,在22.2 g樣品中含(NH4)2SO4應為0.025 mol×1.5=0.037 5 mol,含有NH4HSO4的物質的量為0.1 mol×1.5=0.15 mol。
由于H+—NaOH,則溶液中的H+消耗的NaOH為0.15 mol。
由于![]() —NaOH—NH3,溶液中的
—NaOH—NH3,溶液中的![]() 消耗的NaOH為1.12 L/2.24 L·mol-1=0.05 mol。
消耗的NaOH為1.12 L/2.24 L·mol-1=0.05 mol。
所以,NaOH的總物質的量為0.15 mol+0.05 mol=0.2 mol。
NaOH溶液的物質的量濃度為0.2 mol/0.04 L=5 mol·L-1。
答案:(1)H++OH-![]() H2O,
H2O,![]() +OH-
+OH-![]() NH3↑+H2O (2)0.84 (3)1∶4 (4)Ⅲ 5 mol·L-1
NH3↑+H2O (2)0.84 (3)1∶4 (4)Ⅲ 5 mol·L-1


科目:高中化學 來源:重難點手冊 高中化學·必修1 配人教版新課標 人教版新課標 題型:022
為了預防環境污染并對尾氣進行綜合利用,某硫酸廠用氨水吸收尾氣中的SO2.再向吸收液中加入濃硫酸,以制取高濃度的SO2及(NH4)2SO4和NH4HSO4固體.
為測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現稱取該樣品4份,分別加入相同濃度的NaOH溶液各40.00 mL,加熱至120℃左右,使氨全部逸出[(NH4)2SO4和NH4HSO4固體分解的溫度均高于200℃],測得有關實驗數據如下(標準狀況下):
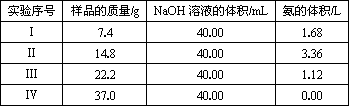
(1)實驗過程中有關反應的離子方程式為________.
(2)由Ⅰ組數據直接預測:標準狀況下3.7 g樣品進行同樣實驗時,生成氨的體積為________L.
(3)該混合物中(NH4)2SO4和NH4HSO4的物質的量之比為________.
查看答案和解析>>
科目:高中化學 來源: 題型:
為了預防環境污染并對尾氣進行綜合利用,某硫酸廠用氨水吸收尾氣中的SO2。再向吸收液中加入濃硫酸,以制取高濃度的SO2及(NH4)2SO4和NH4HSO4固體。
為測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現稱取該樣品4份,分別加入相同濃度的NaOH溶液各40.00 mL,加熱至120 ℃左右,使氨氣全部逸出〔(NH4)2SO4和NH4HSO4固體分解的溫度均高于200 ℃〕,測得有關實驗數據如下:(標準狀況下)
| 實驗序號 | 樣品的質量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
(1)實驗過程中有關反應的離子方程式為_________________________________________。
(2)由Ⅰ組數據直接推測:標準狀況下3.7 g 樣品進行同樣實驗時,生成氨氣的體積為__________L。
(3)試計算該混合物中(NH4)2SO4和NH4HSO4的物質的量之比為__________________。
(4)欲計算該NaOH溶液的物質的量濃度應該選擇__________組數據,由此求得NaOH溶液的物質的量濃度為____________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com