
【題目】MnO2是一種重要的無機功能材料,粗MnO2的提純是工業生產的重要環節.某研究性學習小組設計了將粗MnO2(含有較多的MnO和MnCO3)樣品轉化為純MnO2實驗,其流程如下
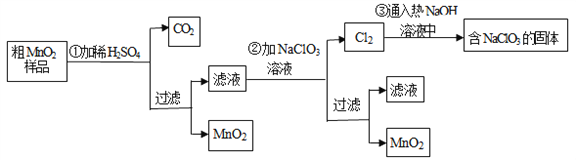
(1)第①步加稀H2SO4時,粗MnO2樣品中的_____________(寫化學式)轉化為可溶性物質.
(2)第②步反應的離子方程式:_______________________
(3)流程中得到MnO2固體操作必需的玻璃儀器有玻璃棒、燒杯、_______________。
(4)已知第③步蒸發得到的固體中有NaClO3和NaOH,則一定還有含有_________(寫化學式).其中用到Cl2的實驗室制法的反應離子方程式:_______________________。
(5)若粗MnO2樣品的質量為50.76g,第①步反應后,經過濾得到34.8gMnO2,并收集到0.896LCO2(標準狀況下),則在第②步反應中至少需要____________ gNaClO3.[M (NaClO3)=106.5]
(6)第①步酸溶產生的CO2與NH3反應可合成化肥尿素[化學式為CO(NH2)2]。己知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CONH2)2(s)+H2O(g); ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
寫出CO2與NH3合成尿素和液態水的熱化學反應方程式______________。
【答案】MnO、MnCO32ClO3-+4H2O+5Mn2+=5MnO2↓+Cl2↑+8H+漏斗NaCl4H++ MnO2+2Cl-![]() Cl2↑+Mn2++2H2O8.522NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l); ΔH=–87.0kJ·mol-1
Cl2↑+Mn2++2H2O8.522NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l); ΔH=–87.0kJ·mol-1
【解析】
試題分析:由制備流程可知,MnO2不溶于硫酸,樣品中的MnCO3和硫酸反應生成可溶性的MnSO4,濾液中含MnSO4,第②步發生5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,第③步中發生氯氣與熱的NaOH發生氧化還原反應生成NaCl、NaClO3、水,溶液蒸發可得到固體,結合選項分析解答。
解析:由制備流程可知,MnO2不溶于硫酸,樣品中的MnCO3和硫酸反應生成可溶性的MnSO4,濾液中含MnSO4,第②步發生5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,第③步中發生氯氣與熱的NaOH發生氧化還原反應生成NaCl、NaClO3、水,溶液蒸發可得到固體,則
(1)只有MnO2不與硫酸反應,則MnO和MnCO3轉化為可溶性物質;
(2)MnSO4要轉化為MnO2,需失去電子,故需要加入NaClO3做氧化劑,依據得失電子守恒可以配平,所以反應的化學方程式是:5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,因此反應的離子方程式是:2ClO3-+4H2O+5Mn2+=5MnO2↓+Cl2↑+8H+;
(3)流程中得到MnO2固體操作是過濾,必需的玻璃儀器有玻璃棒、燒杯、漏斗;
(4)Cl2通入熱的NaOH溶液中一定發生氧化還原反應,且氯氣既做氧化劑又做還原劑,NaClO3屬于氧化產物,因此一定有還原產物NaCl;實驗室制備氯氣的離子方程式為4H++ MnO2+2Cl-![]() Cl2↑+Mn2++2H2O ;
Cl2↑+Mn2++2H2O ;
(5)由題意知樣品中的MnO和MnCO3質量為50.76g-34.8 g=15.96g。0.896LCO2(標準狀況下)是0.04mol,由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物質的量為0.04mol,質量為115g/mol×0.04mol=4.6g,所以MnO的質量為15.96g-4.6g=11.36g,其物質的量為11.36g÷71g/mol=0.16mol,因此與稀硫酸反應時共生成MnSO4的物質的量為0.20mol,根據方程式5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,可計算出需要NaClO3的物質的量為0.08mol,質量是0.08mol×106.5g/mol=8.52g;
(6)己知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CONH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
則根據蓋斯定律可知①-②-③即得到CO2與NH3合成尿素和液態水的熱化學反應方程式為2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=–87.0kJ·mol-1。


科目:高中化學 來源: 題型:
【題目】用軟錳礦(MnO2)、黃鐵礦(FeS2)酸浸生產硫酸錳(MnSO4),并進一步電解制取電解二氧化錳(EMD)的工藝流程如下:
I.將軟錳礦、黃鐵礦和硫酸按一定比例放入反應釜中,攪拌,加熱保溫反應一定時間。
II.向反應釜中加入MnO2、CaCO3試劑,再加入Na2S溶液除掉浸出液中的重金屬。
III.過濾,向濾液中加入凈化劑進一步凈化,再過濾,得到精制MnSO4溶液。
IV.將精制MnSO4溶液送入電解槽,電解制得EMD。
請回答下列問題:
(1)步驟I中攪拌、加熱的目的是________。完成酸浸過程中反應的離子方程式:
![]() FeS2+
FeS2+![]() MnO2+
MnO2+![]() _____=
_____=![]() Mn2++
Mn2++![]() Fe2++ S + SO42-+
Fe2++ S + SO42-+![]() ____
____
(2)加入CaCO3將浸出液pH調至pH=5,從而除掉鐵,請解釋用CaCO3除鐵的原理:________。(結合離子方程式解釋)
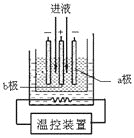
(3)步驟IV中用如圖所示的電解裝置電解精制的MnSO4溶液,生成EMD的是__極(填“a”或“b”),生成EMD的電極反應式是_________。
(4)EMD可用作堿性鋅錳電池的材料。已知堿性鋅錳電池的反應式為:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列關于堿性鋅錳電池的說法正確的是_______(填字母序號)。
A.堿性鋅錳電池是二次電池
B.堿性鋅錳電池將化學能轉化為電能
C.正極反應為:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.堿性鋅錳電池工作時,電子由MnO2經外電路流向Zn極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁是四種短周期元素,乙原子中K層與M層電子數相等;甲原子的核外電子數比乙原子核外電子數少1;丙原子的最外層電子數是次外層電子數的2倍;丁原子核電荷數比丙原子核電荷數多2。請回答:
(1)甲是________元素(填元素名稱,后面小題相同),它在周期表中的位置為______________。
(2)乙是________元素,寫出與乙同主族第六周期元素對應堿的電子式___________________。
(3)丙是________元素,最高價氧化物對應水化物的化學式是_________________;
(4)丁是________元素,甲與丁兩種元素形成既有離子鍵又有共價鍵物質的化學式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉是一種工業鹽,外觀與食鹽非常相似,毒性較強。
Ⅰ.經查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。請設計最簡單的方法鑒別NaNO2和NaCl兩種固體______________________
Ⅱ. 某小組同學用如下裝置(略去夾持儀器)制備亞硝酸鈉
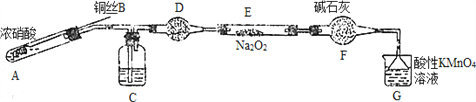
已知:①2NO+Na2O2=2NaNO2; ②酸性條件下,NO和NO2都能與MnO4-反應生成NO3-和Mn2+。
(1)使用銅絲的優點是________________________。
(2)裝置A中發生反應的化學方程式為_____________________________。
裝置C中盛放的藥品是_________;(填字母代號)
A.濃硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)該小組稱取5.000g制取的樣品溶于水配成250ml溶液,取25.00ml溶液于錐形瓶中,
用0.1000mol·L-1酸性KMnO4溶液進行滴定,實驗所得數據如下表所示:
滴定次數 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液體積/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次實驗數據出現異常,造成這種異常的原因可能是_________(填字母代號)。
a.錐形瓶洗凈后未干燥
b.酸式滴定管用蒸餾水洗凈后未用標準液潤洗
c.滴定終點時仰視讀數
②酸性KMnO4溶液滴定亞硝酸鈉溶液的離子方程式為___________________。
③該樣品中亞硝酸鈉的質量分數為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A.含有共價鍵的化合物一定是共價化合物
B.在共價化合物中一定含有共價鍵
C.含有離子鍵的化合物一定是離子化合物
D.全部由非金屬組成的化合物可能是離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~庚等元素在周期表中的相對位置如下表,己的最高氧化物對應水化物有強脫水性,甲和丁在同一周期,甲原子最外層與最內層具有相同電子數.下列判斷正確的是( )
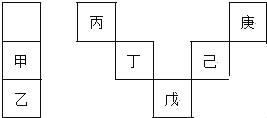
A. 丙與戊的原子序數相差28
B. 氣態氫化物的穩定性:庚<己<戊
C. 常溫下,庚和乙形成的化合物易溶于水
D. 丁的最高價氧化物不與任何酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現如圖所示的物質之間的變化:
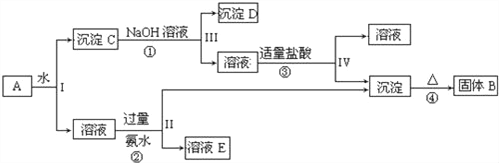
據此回答下列問題:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中對于溶液和沉淀的分離采取的方法是_____.
(2)根據上述框圖反應關系,寫出下列B、C、D、E所含物質的化學式
沉淀固體B______;C________;沉淀D_____;溶液E________.
(3)寫出①、②、③、④四個反應方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com