
【題目】CO2可與H2催化合成甲醇,于恒容密閉容器中,在催化劑作用下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);下列描述能說明該反應已經達到化學平衡狀態的是( )
CH3OH(g)+H2O(g);下列描述能說明該反應已經達到化學平衡狀態的是( )
A.CO2、H2、CH3OH、H2O在容器中共存
B.CO2、H2、CH3OH、H2O的濃度相等
C.正、逆反應速率相等且等于零
D.CO2、H2、CH3OH、H2O的濃度均不再變化
 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:
【題目】某芳香烴A,其相對分子質量為104,碳的質量分數為92.3%。
(1)芳香烴A的分子式為_________,其名稱為_____________。
(2)A可與溴的四氯化碳溶液反應,其化學方程式為____________________,該反應類型為_______。
(3)一定條件下,A與氫氣反應,得到的化合物中碳的質量分數為85.7%,寫出此化合物的結構簡式____________。
(4)在一定條件下,由A聚合得到的高分子化合物的結構簡式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可用于電動汽車的鋁—空氣燃料電池,通常以NaCl溶液或NaOH溶液為電解液,鋁合金為負極,空氣電極為正極。下列說法正確的是( )
A.以NaCl溶液或NaOH溶液為電解液時,正極反應都為:O2+2H2O+4e-=4OH-
B.以NaOH溶液為電解液時,負極反應為:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液為電解液時,電池在工作過程中電解液的pH保持不變
D.電池工作時,電子通過外電路由正極流向負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃料電池具有能量利用率高、可連續使用和污染輕等優點,已成為一種發展前景十分廣闊的化學電源。氫氧燃料電池是目前最成熟的燃料電池,它可以使用不同的電解質,如酸式、堿式、熔融碳酸鹽、固體電解質等。回答以下問題。
(1)通人氧氣的一極為___________極,若電解質溶液為硫酸溶液,負極反應式為____________,若電解質溶液為KOH溶液,正極反應式為____________。
(2)若將氫氣改為CH4,電解質溶液為KOH溶液,此時負極反應式為__________,一段時間后,電解質溶液的OH-的濃度將____________(填“增大”“減小”或“不變”)。
(3)肼(N2H4)-空氣燃料電池是一種堿性燃料電池,電解質溶液是20%30%的KOH溶液。已知N2H4燃燒產物之一為空氣中含量最高的一種氣體。肼-空氣燃料電池放電時負極的電極反應式為___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對羥基苯甲酸丁酯(俗稱尼泊金丁酯)可用作防腐劑,對酵母和霉菌有很強的抑制作用,工業上常用對羥基苯甲酸與丁醇在濃硫酸催化下進行酯化反應而制得,以下是某課題組開發的從廉價、易得的化工原料出發制備對羥基苯甲酸丁酯的合成路線:
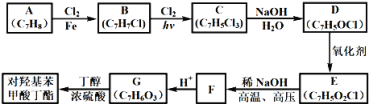
已知以下信息:
①通常在同一個碳原子上連有兩個羥基不穩定,易脫水形成羰基;②D可與銀氨溶液反應生成銀鏡;③F的核磁共振氫譜表明其有兩種不同化學環境的氫,且峰面積比為1﹕1。
回答下列問題:
(1)A的化學名稱為________;
(2)由B生成C的化學反應方程式為_______,該反應的類型為_______;
(3)D的結構簡式為________;
(4)F的分子式為_______;
(5)G的結構簡式為________;
(6)E的同分異構體中含有苯環且能發生銀鏡反應的共有_______種,其中核磁共振氫譜有三種不同化學環境的氫,且峰面積比為2﹕2﹕1的是______(寫結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,具支試管內壁用水濕潤后,放入鐵粉、碳粉,導管插入到紅墨水中。下列描述錯誤的是( )
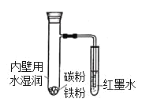
A.具支試管底部發熱
B.負極電極反應式:Fe-2e-=Fe2+
C.反應結束后,最終導管內液面下降
D.正極電極反應式:2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁熱法是鋁與某些金屬氧化物反應獲得高熔點金屬單質的方法。工業上可用于制造無碳或低碳鐵合金。鋁粉和赤鐵礦發生鋁熱反應的化學方程式為:Fe2O3+2Al![]() 2Fe+Al2O3。
2Fe+Al2O3。
(1)上述反應中,作為氧化劑的物質是__,化合價升高的元素是__。
(2)若反應中消耗了0.2molAl,生成Fe的物質的量為__mol,轉移電子的物質的量為__mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值.下列說法正確的是( )
A. 46g乙醇中存在的共價鍵總數為7NA
B. 1mol甲醇完全燃燒時,轉移的電子數為6NA
C. 標準狀況下,22.4L甲烷和22.4L氯仿所具有的微粒數均為NA
D. 1 L 0.1mol/L醋酸溶液中含有的氫離子數為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“封管實驗”具有簡易、方便、節約、綠色等優點,下列關于三個“封管實驗”(夾持裝置未畫出)的說法正確的是( )

A. 加熱時,①中上部匯集了NH4Cl固體
B. 加熱時,②中溶液變紅,冷卻后又都變為無色
C. 加熱時,③中溶液紅色褪去,冷卻后溶液變紅,體現SO2的漂白性
D. 三個“封管實驗”中所發生的化學反應都是可逆反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com