
【題目】某種新型高分子材料的結構簡式為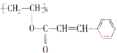 ,對此高聚物敘述不正確的是( )
,對此高聚物敘述不正確的是( )
A.化學式為(C11H10O2)n
B.可以發生水解反應、氧化反應,也能發生鹵代反應
C.1 mol 該有機物分子最多能和4 mol H2發生加成反應
D.該高分子材料是經加聚反應而得到
科目:高中化學 來源: 題型:
【題目】已知1克氫氣完全燃燒成水蒸氣放出121kJ,1 mol O=O鍵完全斷裂吸收496 kJ,1 mol H—O鍵形成時放出463 kJ,則氫氣中1 mol H—H鍵斷裂時吸收能量為( )
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用零價鐵(Fe)去除水體中的硝酸鹽(NO3-)已成為環境修復研究的熱點之一。

(1)Fe還原水體中NO3-的反應原理如圖1所示。
①作負極的物質化學式為___________。
②正極的電極反應式是_________________________________________。
(2)將足量鐵粉投入水體中,經24小時測定NO3-的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小時pH | 接近中性 | 接近中性 |
鐵的最終物質形態 |
|
|
pH=4.5時,NO3-的去除率低。其原因是_____________________________________。
(3)實驗發現:在初始pH=4.5的水體中投入足量鐵粉的同時,補充一定量的Fe2+可以明顯提高NO3-的去除率。對Fe2+的作用提出兩種假設:
Ⅰ.Fe2+直接還原NO3-;
Ⅱ.Fe2+破壞FeO(OH)氧化層。
①做對比實驗,結果如圖2所示,可得到的結論是____________________。
②同位素示蹤法證實Fe2+能與FeO(OH)反應生成Fe3O4,該反應的離子方程式為_________,解釋加入Fe2+提高NO3-去除率的原因:_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廢水中可能存在的離子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、CO32-、S2-、SO32-、SO42-。現取該溶液進行有關實驗,實驗過程及現象如圖所示:
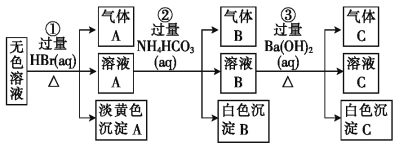
下列說法不正確的是
A.根據實驗①中的現象可推出,淡黃色沉淀一定不是AgBr
B.根據實驗②中的現象可推出,氣體B是CO2,沉淀B是Al(OH)3,原溶液中一定含有AlO2-
C.根據實驗③中的現象可推出,氣體C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能確定是否含有SO32-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是一種強還原性的堿性液體,是一種用途廣泛的化工原料,實驗室用如圖裝置制備(部分裝置省略)。
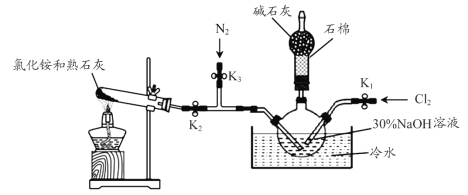
步驟1關閉K2、K3,打開K1,制備NaClO。
步驟2關閉K1、K2,打開K3,通入N2一段時間;關閉K3,打開K2,通入NH3,制備N2H4·H2O。
回答下列問題:
(1)盛放堿石灰的儀器的名稱為___________。
(2)配制30%NaOH溶液時,所需玻璃儀器除量筒外還有__________(填標號)。
A.容量瓶 B.燒杯 C.燒瓶 D.玻璃棒
(3)步驟2中通入N2一段時間的原因是____________________。
(4)本裝置中制備氨氣的化學方程式是______________________________。
(5)NH3與NaClO反應生成N2H4·H2O的化學方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向等物質的量濃度Na2S、NaOH混合溶液中滴加稀鹽酸至過量。其中主要含硫各物種(H2S、HS-、S2-)的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與滴加鹽酸體積的關系如圖所示(忽略滴加過程H2S氣體的逸出)。下列說法不正確的是

A.含硫物種B表示HS-
B.在滴加鹽酸過程中,溶液中c(Na+)與含硫各物種濃度的大小關系:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C.X,Y為曲線的兩交叉點,若能知道X點處的pH,就可以計算出H2S的Ka值
D.NaHS呈堿性,若向溶液中加入CuSO4溶液,恰好完全反應,所得溶液呈強酸性,其原因是Cu2++HS-===CuS↓+H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向2L密閉容器中通入amol氣體A和bmol氣體B,在一定條件下發生反應:xA(g)+yB(g) ![]() pC(g)+qD(g)已知:平均反應速率v(C)=
pC(g)+qD(g)已知:平均反應速率v(C)=![]() v(A);反應2min時,A的濃度減少了
v(A);反應2min時,A的濃度減少了![]() ,B的物質的量減少了
,B的物質的量減少了![]() mol,有
mol,有![]() molD生成。回答下列問題:
molD生成。回答下列問題:
(1)反應2min內,v(A)=______________;v(B)=______________;
(2)下列敘述能說明該反應已達平衡狀態的是:______;
A、 xV(A)正=qV(D)逆 B、氣體總的質量保持不變 C、C的總質量保持不變 D、混合氣體總的物質的量不再變化 E、混合氣體總的密度不再變化 F、混合氣體平均分子量不再變化
(3)反應平衡時,D為2amol,則B的轉化率為________;
(4)其他條件不變,將容器的容積變為1L,進行同樣的實驗,則與上述反應比較,反應速率_____(是“增大”“減小”或“不變”),
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《科學美國人》評出的2016年十大創新技術之一是碳呼吸電池,電池原理如圖所示,則下列有關說法正確的是
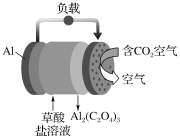
A.以此電池為電源電解精煉銅,當有0.1 mol 電子轉移時,有3.2 g銅溶解
B.正極每消耗4.48L的CO2,則生成0.1molC2O42-
C.每生成1 mol Al2(C2O4)3,有6 mol電子流過草酸鹽溶液
D.隨著反應進行,草酸鹽濃度不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究乙烯與溴的加成反應,甲同學設計并進行如下實驗:先用乙醇和濃硫酸為原料制取乙烯(CH3CH2OH![]() CH2=CH2↑+H2O),將生成的氣體直接通入溴水中,發現溶液褪色,即證明乙烯與溴水發生了加成反應。(已知:乙烯可以被濃硫酸氧化,有SO2生成)
CH2=CH2↑+H2O),將生成的氣體直接通入溴水中,發現溶液褪色,即證明乙烯與溴水發生了加成反應。(已知:乙烯可以被濃硫酸氧化,有SO2生成)
乙同學發現在甲同學的實驗中,產生的氣體有刺激性氣味,推測在制得的乙烯中還可能含有少量還原性的雜質氣體,由此提出必須先除去雜質,再與溴水反應。
請你回答下列問題:
(1)甲同學設計的實驗________(填“能”或“不能”)驗證乙烯與溴水發生了加成反應,其理由是___________________。
A.使溴水褪色的反應,未必是加成反應
B.使溴水褪色的反應,就是加成反應
C.使溴水褪色的物質,未必是乙烯
D.使溴水褪色的物質,就是乙烯
(2)乙同學推測此乙烯中必定含有一種雜質氣體是________,它與溴水反應的化學方程式是_________________。在驗證過程中必須全部除去。為此,乙同學設計了如圖所示的實驗裝置:
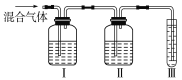
請回答:Ⅰ、Ⅱ、Ⅲ裝置中可盛放的試劑是:Ⅰ________、Ⅱ________、Ⅲ________(填序號)。
A.品紅 B.NaOH溶液
C.溴水 D.酸性高錳酸鉀溶液
(3)為驗證這一反應是加成反應而不是取代反應,丙同學提出可用pH試紙來測試反應后溶液的酸性,理由是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com