
【題目】化合物G是一種藥物合成中間體,其合成路線如圖:
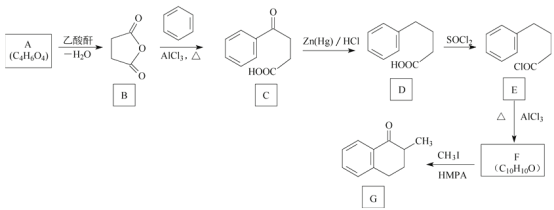
已知A分子中只含有一種官能團且能與![]() 反應生成
反應生成![]() 。回答下列問題:
。回答下列問題:
(1)A的化學名稱是___________。
(2)C中的官能團名稱是___________。
(3)D生成E的反應類型是___________。
(4)F的結構簡式是___________。
(5)A與乙二醇在催化劑作用下反應生成可生物降解型聚酯PES,該反應的化學方程式為_________。
(6)X是G的同分異構體,滿足下列條件的X共有___________種(不考慮立體異構)
①含苯環且苯環上只有三個取代基;
②含醛基且與苯環直接相連;
③除苯環外不含其他環狀結構。
若①改成含苯環且苯環上只有二個取代基,其他條件不變,其中核磁共振氫譜有5組峰,面積比為6∶2∶2∶1∶1的是________(寫結構簡式)。
(7)由苯和甲苯制備![]() 的合成路線如下:
的合成路線如下:
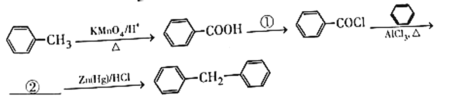
填寫:①___________②___________
【答案】丁二酸(或1,4-丁二酸) 羰基和羧基 取代反應 
![]()
![]()
![]() 40
40 ![]()
![]()
![]()
【解析】
根據題干信息A分子中只含有一種官能團且能與![]() 反應生成
反應生成![]() ,說明A中含有羧基一種官能團,結合A的分子式和A到B的條件和B的結構簡式可以推導出A的結構簡式為HOOCCH2CH2COOH,結合E和G的結構簡式可以推導出F的結構簡式為
,說明A中含有羧基一種官能團,結合A的分子式和A到B的條件和B的結構簡式可以推導出A的結構簡式為HOOCCH2CH2COOH,結合E和G的結構簡式可以推導出F的結構簡式為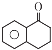 ,然后進行解答。
,然后進行解答。
(1)根據分析可知, A的結構簡式為HOOCCH2CH2COOH,故化學名稱丁二酸或者1,4-丁二酸,故答案為:丁二酸(或者1,4-丁二酸);
(2)C的結構簡式為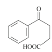 中,其含有的官能團有羧基和羰基,故答案為:羰基和羧基;
中,其含有的官能團有羧基和羰基,故答案為:羰基和羧基;
(3)D生成E的過程是![]() ,可以看成D中羧基上的羥基被SOCl2中的Cl原子所代替,故反應類型屬于取代反應,故答案為:取代反應;
,可以看成D中羧基上的羥基被SOCl2中的Cl原子所代替,故反應類型屬于取代反應,故答案為:取代反應;
(4)根據分析中可知F的結構簡式是 ,故答案為:
,故答案為: ;
;
(5)丁二酸與乙二醇在催化劑作用發生縮聚反應生成可生物降解型聚酯PES,該反應的化學方程式為![]()
![]()
![]() ,故答案為:
,故答案為:![]()
![]()
![]() ;
;
(6)X是G的分子式為C11H12O,其滿足①含苯環且苯環上只有三個取代基;②含醛基且與苯環直接相連;③除苯環外不含其他環狀結構三個條件的同分異構體有:由分子式可知其不飽和度為6,除去苯環和醛基還有一個不飽和度,又不含其他環狀,故一定有碳碳雙鍵,故苯環上所連三個取代基的情況有如下(1)-CHO、–CH2CH3、–CH=CH2(2)-CHO、–CH=CHCH3、–CH3(3)-CHO、、-CH3(4)-CHO、-CH2CH=CH2、-CH3,我們進行歸類處理,假設連在苯環上的三個不同基團分別為a、b、c,則如圖
 (c有4種連法),
(c有4種連法),![]() (c有4種連法),
(c有4種連法),![]() (c有2種連法),故每一組都有10種不同的結構,故共有40種同分異構體,答案為:40;
(c有2種連法),故每一組都有10種不同的結構,故共有40種同分異構體,答案為:40;
若①改成含苯環且苯環上只有二個取代基,則取代基可能為:醛基和-CH=CHCH2CH3![]() 、CH2=CHCH2CH2-或者-CH2CH=CHCH3、
、CH2=CHCH2CH2-或者-CH2CH=CHCH3、 ![]() 、
、
-CH=C(CH3)2、 ![]() ,其中核磁共振氫譜有5組峰說明分子高度對稱結構,且峰積比為6∶2∶2∶1∶1的是
,其中核磁共振氫譜有5組峰說明分子高度對稱結構,且峰積比為6∶2∶2∶1∶1的是 ![]() ,故答案為:
,故答案為:![]() ;
;
(7) 根據題干流程圖D到E這步獲得信息可知①是SOCl2,結合題干流程圖信息E到F提供的信息可知②的結構簡式為:![]() ,故答案為:SOCl2
,故答案為:SOCl2 ![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列有關物質性質的敘述錯誤的是
A. 將過量氨氣通入CuSO4溶液中可得深藍色溶液
B. 蛋白質溶于水所得分散系可產生丁達爾效應
C. 硅酸鈉溶液與稀鹽酸反應可生成硅酸膠體
D. 過量鐵粉在氯氣中燃燒可生成氯化亞鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X+、Y2+、Z-、W2-四種離子均具有相同的電子層結構。下列關于X、Y、Z、W四種元素的描述,不正確的是( )
A.原子序數:Y>X>Z>WB.離子半徑:X+>Y2+>Z->W2-
C.原子最外層電子數:Z>W>Y>XD.還原性:X>Y,W2->Z-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用鹽酸的質量分數為36.5%,密度為1.20 g·mL-1。
(1)此濃鹽酸中HCl的物質的量濃度是________。
(2)配制100 mL該濃鹽酸,需要標準狀況下HCl的體積為________。
(3)配制100 mL 3.00 mol·L-1的鹽酸,需以上濃鹽酸的體積為________。
(4)將10.0 mL 3.00 mol·L-1的鹽酸與10.0 mL 1.00 mol·L-1的MgCl2溶液混合,則混合溶液中Cl-的物質的量濃度是________。(設混合后溶液的體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇耐高溫、易存儲熱值高、節能環保,可做燃料,又是重要的化工原料。科學家用太陽能分解水生成的氫氣在催化劑作用下與![]() 反應生成甲醇。已知:
反應生成甲醇。已知:![]() 、
、![]() 和
和![]() 的燃燒熱H分別為
的燃燒熱H分別為![]() 、
、![]() 和
和![]() 。請回答下列問題:
。請回答下列問題:
(1)用太陽能分解![]() 水消耗的能量是________
水消耗的能量是________![]() 。
。
(2)甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為________。
(3)![]() 催化加氫合成甲醇(反應Ⅱ)中伴隨著反應Ⅰ的發生:
催化加氫合成甲醇(反應Ⅱ)中伴隨著反應Ⅰ的發生:
反應Ⅰ:![]()
反應Ⅱ:![]()
在恒壓、![]() 和
和![]() 的起始量一定的條件下,
的起始量一定的條件下,![]() 平衡轉化率和平衡時
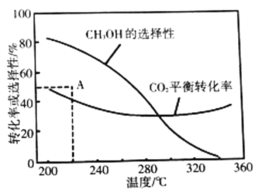
平衡轉化率和平衡時![]() 的選擇性隨溫度的變化如圖。其中:
的選擇性隨溫度的變化如圖。其中:![]() 的選擇性
的選擇性![]()
①溫度高于300℃,![]() 平衡轉化率隨溫度升高而上升的原因是_________。
平衡轉化率隨溫度升高而上升的原因是_________。
②220℃時,在催化劑作用下![]() 與
與![]() 反應一段時間后,測得
反應一段時間后,測得![]() 的選擇性為48%(圖中A點)。不改變反應時間和溫度,一定能提高
的選擇性為48%(圖中A點)。不改變反應時間和溫度,一定能提高![]() 選擇性的措施有_________________(寫出兩點)。
選擇性的措施有_________________(寫出兩點)。
(4)在體積為![]() 的密閉容器中充入
的密閉容器中充入![]() 和
和![]() 發生反應Ⅱ,到平衡時氫氣的轉化率為25%,求該反應的平衡常數K=________。(結果保留二位有效數字)
發生反應Ⅱ,到平衡時氫氣的轉化率為25%,求該反應的平衡常數K=________。(結果保留二位有效數字)
(5)研究證實,![]() 也可在硫酸溶液中用惰性電極電解生成甲醇,生成甲醇的電極反應式為__________,另一極電解產物是________________。
也可在硫酸溶液中用惰性電極電解生成甲醇,生成甲醇的電極反應式為__________,另一極電解產物是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為研究廢舊電池的再利用,實驗室利用舊電池的銅帽(主要成分為Zn和Cu)回收Cu并制備ZnO的部分實驗過程如圖所示。下列敘述錯誤的是( )
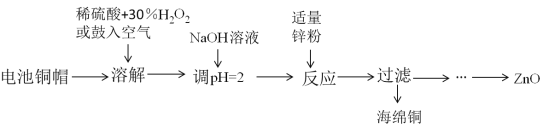
A.“溶解”操作中溶液溫度不宜過高
B.銅帽溶解后,將溶液加熱至沸騰以除去溶液中過量的氧氣或H2O2
C.與鋅粉反應的離子可能為Cu2+、H+
D.“過濾”后,將濾液蒸發結晶、過濾、洗滌、干燥后高溫灼燒可得純凈的ZnO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,N表示粒子數。下列敘述正確的是( )
A.6.0gSiO2晶體中含有共價鍵的個數為0.2NA
B.將1molCl2通入水中,則N(HClO)+N(Cl-)+N(ClO-)=2NA
C.3.0g含甲醛(HCHO)的冰醋酸中含有的原子總數為0.4NA
D.將CO2通過Na2O2使其質量增加ag時,反應轉移的電子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純硅是現代信息、半導體和光伏發電等產業都需要的基礎材料。工業上提純硅有多種路線,其中一種工藝流程示意圖及主要反應如下:

下列說法正確的是 ( )
A. 自然界中存在大量的單質硅
B. 步驟電弧爐中的化學方程式為SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能與氫氟酸反應,而硅不能與氫氟酸反應
D. SiHCl3(沸點33.0 ℃)中含有少量的SiCl4(沸點67.6 ℃),通過蒸餾(或分餾)可提純SiHCl3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在題圖所示的情境中,下列有關說法正確的是
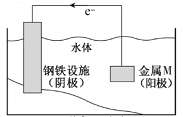
A.陰極的電極反應式為![]()
B.金屬M的活動性比Fe的活動性弱
C.鋼鐵設施表面因積累大量電子而被保護
D.鋼鐵設施在河水中的腐蝕速率比在海水中的快
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com