
【題目】化學反應原理對生產有重大的指導意義。回答下列問題:
(1)有兩個溫度相同的密閉容器A和B,容器A保持容積不變,容器B保持壓強不變,起始時向容積相等的A、B中分別充入等量的C(碳)和H2O(g),發生反應:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反應為吸熱反應),并分別達到平衡。
CO(g)+ H2(g) (正反應為吸熱反應),并分別達到平衡。
①H2O的體積分數:V(A)%_____V(B)%。(填“>”、“<” “=”)
②達到平衡后,在兩容器中分別通入等量的氦氣,則A中H2O的轉化率_______(填“增大” “減小”、“不變”);B中化學平衡_________移動(填“不”“向正反應方向”“向逆反應方向”)。
(2)某溫度下,測得0.01mol·L-1 NaOH溶液的pH=10,則在該溫度下Kw=______;在此溫度下,將pH=11的NaOH溶液aL與pH=2的H2SO4溶液bL混合,若所得溶液為中性,則a:b=_______(假設混合時體積不變)。
【答案】 > 不變 向正反應方向 1×10-12 1:10
【解析】試題分析:本題考查外界條件對化學平衡的影響,水的離子積的計算,酸堿混合溶液pH的計算。
(1)① 反應C(s)+H2O(g)![]() CO(g)+ H2(g)的特點是:正反應是氣體分子數增大的反應。建立平衡過程中氣體分子物質的量增大,平衡時氣體分子物質的量大于起始物質的量;A為恒溫恒容容器,建立平衡過程中A中氣體壓強增大,平衡時壓強大于起始時壓強;B為恒溫恒壓容器,建立平衡過程中B的體積增大,平衡時體積大于起始時體積;平衡時A中壓強大于B中壓強,B相當于在A達到平衡后減小壓強,減小壓強平衡向正反應方向移動,H2O的體積分數減小,V(A)%
CO(g)+ H2(g)的特點是:正反應是氣體分子數增大的反應。建立平衡過程中氣體分子物質的量增大,平衡時氣體分子物質的量大于起始物質的量;A為恒溫恒容容器,建立平衡過程中A中氣體壓強增大,平衡時壓強大于起始時壓強;B為恒溫恒壓容器,建立平衡過程中B的體積增大,平衡時體積大于起始時體積;平衡時A中壓強大于B中壓強,B相當于在A達到平衡后減小壓強,減小壓強平衡向正反應方向移動,H2O的體積分數減小,V(A)%![]() V(B)%。
V(B)%。
②A為恒溫恒容容器,通入氦氣,各物質的濃度不變,化學平衡不移動,A中H2O的轉化率不變。B為恒溫恒壓容器,通入氦氣,體積增大,相當于減小壓強,平衡向正反應方向移動。
(2)0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,pH=10即c(H+)=1![]() 10-10mol/L,該溫度下KW=c(H+)·c(OH-)=1
10-10mol/L,該溫度下KW=c(H+)·c(OH-)=1![]() 10-10mol/L
10-10mol/L![]() 0.01mol/L=1
0.01mol/L=1![]() 10-12mol2·L-2。因為NaOH溶液與H2SO4溶液混合后溶液為中性,則NaOH溶液中的OH-物質的量等于H2SO4溶液中H+物質的量,
10-12mol2·L-2。因為NaOH溶液與H2SO4溶液混合后溶液為中性,則NaOH溶液中的OH-物質的量等于H2SO4溶液中H+物質的量, ![]() mol/L
mol/L![]() aL=1
aL=1![]() 10-2mol/L
10-2mol/L![]() bL,則a:b=1:10。
bL,則a:b=1:10。


科目:高中化學 來源: 題型:
【題目】在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g) ![]() 2NO2(g),隨溫度升高,混合氣體的顏色變深。
2NO2(g),隨溫度升高,混合氣體的顏色變深。
(1)反應的ΔH________0(填“大于”或“小于”);100 ℃時,體系中各物質濃度隨時間變化如圖所示。在0~60 s時段,反應速率v(N2O4)為________mol·L-1·s-1;反應的平衡常數K1為_____________。
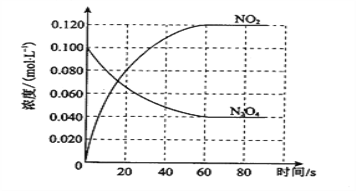
(2)100 ℃時達到平衡后,改變反應溫度為T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,經10 s又達到平衡。T______100 ℃(填“大于”或“小于”),判斷理由是____________________________________________。
(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向________(填“正反應”或“逆反應”)方向移動,判斷理由是____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,pH=l 的某溶液 A 中除H+外,還含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4種,且溶液中各離子的物質的量濃度均為0.1mol·L-1。現取該溶液進行有關實驗,實驗結果如下圖所示,下列有關說法正確的是

A. 該溶液中一定有上述離子中的NO3-、Al3+、SO42-、Cl-四種離子
B. 實物消耗Cu14.4g,則生成氣體丁的體積為3.36L
C. 該溶液一定沒有Fe3+,但是無法確定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣中可吸入顆粒物PM2.5主要來源為燃煤、機動車尾氣等。
(1)若取某PM2.5樣本,用蒸餾水處理,測得溶液中含有的離子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,該溶液呈酸性,其原因用離子方程式解釋是:____________。
(2)“洗滌”燃煤煙氣可減輕PM2.5中SO2的危害,下列可適用于吸收SO2的試劑有(____)
a.CaCl2溶液 b.氨水 c.Ca(OH)2懸濁液 d.濃H2SO4
(3)煤煙氣中的氮氧化物可用CH4催化還原成無害物質。若常溫下,1molNO2與CH4反應,放出477.5kJ熱量,該反應的熱化學方程式是 __________ 。
(4)安裝汽車尾氣催化轉化器也可減輕PM2.5的危害,其反應是:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g);△H<0。該反應平衡常數表達式K= ________;溫度升高K值______(填“增大”或“減小” )
2CO2(g) + N2(g);△H<0。該反應平衡常數表達式K= ________;溫度升高K值______(填“增大”或“減小” )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,將224 L氯化氫氣體溶于635 mL的水(密度為1.00 g/cm3)中,所得鹽酸的密度為1.18 g/cm3。求:
(1)該鹽酸的溶質質量分數是多少?______________
(2)取這種鹽酸10.0 mL,稀釋到1.00 L,所得的稀鹽酸的物質的量濃度多少?____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維爾納配合物M是一種橙黃色單斜晶體,該晶體以濃氨水、雙氧水、CoCl2·6H2O、NH4Cl為原料在加熱條件下通過活性炭的催化來合成。為探究該晶體的組成,設計了如下實驗:
步驟一,氮的測定:準確稱取一定量橙黃色晶體,加入適量水溶解,注入下圖所示的三頸瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸氣,將樣品中的氨全部蒸出,用500.00mL7.0mol/L的鹽酸溶液吸收,吸收結束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定過量的鹽酸,終點消耗NaOH溶液12.50mL。
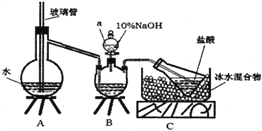
步驟二,氯的測定:準確稱取橙黃色晶體wg,配成溶液后用AgNO3標準溶液滴定,以K2CrO4溶液為指示劑,至出現淡紅色沉淀不再消失為終點(Ag2CrO4為磚紅色沉淀)。
(1)上述裝置A中,玻璃管的作用是________;裝置B中儀器a的名稱為_________。
(2)裝置A、B三腳架處應放置一個酒精燈作為熱源,酒精燈應放置在____(填“A”或“B”)處。
(3)步驟一所稱取的樣品中含氮的質量為_________g。
(4)有同學提出裝置C中所用鹽酸的濃度過大易揮發,會造成測得氮的含量結果將_______(填“偏高”、“偏低”或“無影響”);冰水混合物的作用是___________。
(5)測定氯的過程中,使用棕色滴定管的原因是_________;出現淺紅色沉淀時,若溶液中c(CrO42-)=0.0025mol/L,通過計算說明該實驗可以使用K2CrO4溶液為指示劑的原因______(呈現計算過程)。已知:Ksp(Ag2CrO4)=1.0×10-12Ksp(AgCl)=1.8×10-10
(6)經上述實驗測定,配合物M中鈷、氮、氯的物質的量之比為1:6:3,其中氮元素以氨的形式存在。制備M的化學方程式為_____________________,其中雙氧水的作用是__________;制備M的過程中溫度不能過高的原因是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酒后駕車是馬路上的第一大殺手。已知酒精(C2H5OH)能與K2Cr2O7和H2SO4的混合溶液在一定條件下發生如下反應:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分別顯橙色和綠色,回答下列問題:
(1)該反應________(填“是”或“不是”)離子反應。
(2)寫出Cr2(SO4)3的電離方程式:______________________________________。
(3)該反應________(填“是”或“不是”)氧化還原反應,判斷的依據是_________________________________。
(4)你認為能否用這一反應來檢測司機是否酒后駕車?________(填“能”或“不能” ),簡述其原理________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩個體積相同的容器,一個盛有NO,另外一個盛有N2和O2,在標準狀況下兩容器內的氣體一定具有相同的( )
①原子總數;②質子總數;③分子總數;④質量
A.①②B.②④C.②③D.①③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖裝置中,U型管內為紅墨水,a,b試管內分別盛有食鹽水和氯化鐵溶液。各加入生鐵塊放置一段時間。下列有關描述錯誤的是( )
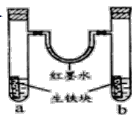
A. 生鐵比純鐵更易被腐蝕
B. 紅墨水柱兩邊的液面變為左高右低
C. 兩試管中相同的電極反應式是:Fe-2e-→Fe2+
D. a試管中發生了吸氧腐蝕,正極反應式為O2+4e-+4H+=2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com