
研究硫及其化合物對于工農業生產具有重要意義。
(1)圖Ⅰ所示一個容積為4L的密閉容器,內有可移動的隔板。一定溫度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化劑存在下分別發生反應:

左室: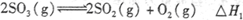
右室:
反應達到平衡時,右室反應過程和能量關系如圖Ⅱ所示。
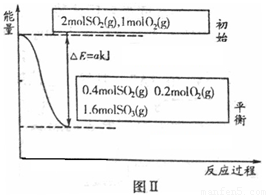
①ΔH2=_______(含a的數學式表示);反應的平衡常數K=_________L·mol-1。
②能說明兩邊反應一定達到平衡的是______________(填序號)。
A.隔板不再移動
B.左右兩邊SO2的物質的量相等
C.左右二室中SO2與O2物質的量之比都是2∶1
③達平衡時,左室反應吸收的熱量為Q1kJ,右室反應吸收的熱量為Q2kJ,則Q1、Q2滿足的關系是_____________(填序號)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高溫下,熾熱的Cu2S與水蒸氣反應生成金屬銅、H2和SO2(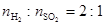 )。
)。
①寫出該反應的化學反應方程式_____________________________________________。
②若有1 mol Cu2S參與反應,則轉移電子的物質的量是_________mol。
(1)①-1.25a kJ/mol 160
② AB ③ C
(2)①Cu2S+2H2O 2Cu+ 2SO2 + H2
②6
2Cu+ 2SO2 + H2
②6
【解析】
試題分析:(1)①由圖Ⅱ可以得出,反應物2molSO2平衡時為0.4mol,反應了1.6mol產生akJ的熱量,故該反應的△H2=-2a/1.6=-1.25a kJ/mol相同條件下,左右室反應為等效平衡,達到平衡后兩邊體積相等為2L,
K=c2(SO3)/ c2(SO2) c(O2)=0.82/(0.22×0.1)=160
②A、該反應方程式兩邊化學計量數和不等,平衡移動會導致氣體體積變化,隔板不動,即說明反應達到平衡,正確;B、兩邊是等效平衡,平衡后完全相同,若不相等則沒有達到平衡,正確;C、加入的量是比是2∶1,反應的量為比也是2∶1,所以任何時間左右二室中SO2與O2物質的量之比都是2∶1,錯誤。
③平衡狀態時SO3的物質的量為1.6mol,顯然左室反應的量少,吸收的熱量比右室反應的放出的熱量少,所以Q1<Q2
(2)①該反應化學方程式為Cu2S+2H2O 2Cu+ 2SO2 + H2
②6
2Cu+ 2SO2 + H2
②6
考點:考查STS中環境保護有關問題。


湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com