
【題目】(1)下圖中甲池的總反應式為N2H4+O2===N2+2H2O。甲池中負極上的電極反應式為_________,乙池中石墨電極上發生的反應為_______________。甲池中每消耗0.1 mol N2H4,乙池電極上則會析出_________ g固體。

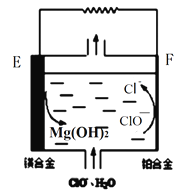
(2)鎂燃料電池在可移動電子設備電源和備用電源等方面應用前景廣闊。下圖為“鎂—次氯酸鹽”燃料電池原理示意圖,電極為鎂合金和鉑合金。E為該燃料電池的_______極(填“正”或“負”)。F電極上的電極反應式為______________。
(3)下圖為電化學法生產硫酸的工藝示意圖,電池以固體金屬氧化物作電解質,該電解質能傳導O2-離子。S(g)在負極生成SO3的電極反應式為____________________。已知S(g)在負極發生的反應為可逆反應,為提高硫蒸氣的轉化率,該工藝采取的措施有____________(任寫一條)。

【答案】N2H4+4OH--4e-===N2+4H2O 2H2O-4e-===O2↑+4H+或4OH--4e-===2H2O+O2↑ 12.8 負 ClO- + 2e- + H2O = Cl-+ 2OH- S- 6e- +3O2- = SO3 硫磺(二氧化硫)循環使用;用稀硫酸吸收SO3(減小生成物濃度,有利于提高S轉化率)
【解析】
(1)甲池為燃料電池,N2H4失電子生成氮氣;乙池為電解池,石墨電極與正極相連為陽極,氫氧根在陽極失電子發生氧化反應;根據電路中每個電極得失電子守恒計算;
(2)原電池中,負極上失電子發生氧化反應,化合價升高,正極上得電子發生還原反應,化合價降低,據此圖示判斷正負極,并書寫電極反應式;
(3)根據圖示,S轉化為SO2和SO3,發生氧化反應,結合電解質為固體金屬氧化物書寫電極反應式;結合平衡移動原理分析提高轉化率的方法。
(1)甲池為燃料電池,負極上發生氧化反應,電極反應式為N2H4-4e-+4OH-=N2+4H2O;乙池為電解池,石墨電極與正極相連為陽極,氫氧根在陽極失電子發生氧化反應,反應式為4OH--4e-=2H2O+O2↑;甲池中每消耗0.1molN2H4,則根據負極N2H4-4e-+4OH-=N2+4H2O,轉移0.4mol電子,所以乙池電極上則會析出![]() ×64g/mol=12.8g銅,故答案為:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
×64g/mol=12.8g銅,故答案為:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
(2)①燃料電池中,負極上燃料失電子發生氧化反應,化合價升高,正極上氧化劑得電子發生還原反應,化合價降低,根據圖知,Mg元素化合價由0價變為+2價、Cl元素化合價由+1價變為-1價,所以E是負極、F是正極,正極上次氯酸根離子得電子和水反應生成氯離子和氫氧根離子,電極反應式為ClO-+2e-+H2O═Cl-+2OH-,故答案為:負;ClO-+2e-+H2O═Cl-+2OH-;
(3)根據圖示,S轉化為SO2和SO3,S元素的化合價升高,發生氧化反應,則S為負極,通氧氣一端為正極,S(g)在負極生成SO2和SO3的電極反應式為S-4e-+2O2-=SO2、S-6e-+3O2-=SO3;若提高轉化率,則平衡正向移動,所以可采取硫磺(二氧化硫)循環使用或用稀硫酸吸收三氧化硫,故答案為:S-6e-+3O2-=SO3;硫磺(二氧化硫)循環使用;用稀硫酸吸收三氧化硫。


科目:高中化學 來源: 題型:
【題目】高分子化合物H的合成路線如下:

已知:i. 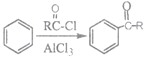
ii. 
回答下列問題
(1)A的化學名稱為___________。
(2)B→C的化學方程式為______________________。
(3)E的結構簡式為___________;由E生成F的反應類型為______________________。
(4)G中官能團名稱為___________;由G→H的化學方程式為______________________。
(5)芳香族化合物L與G的官能團相同,但L的相對分子質量比G小28。則符合下列條件的L的同分異構體有___________種。
①與FeCl3溶液發生顯色反應 ②苯環上有3個取代基
(6)按 有機合成路線可以制備
有機合成路線可以制備 。結合題中流程和已知信息,可推知M、N的結構簡式分別為___________、___________。
。結合題中流程和已知信息,可推知M、N的結構簡式分別為___________、___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】決定物質性質的重要因素是物質結構。請回答下列問題:
(1)已知元素M是組成物質Ca5(PO4)3F的一種元素。元素M的氣態原子逐個失去第1個至第5個電子所需能量(即電離能,用符號I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
電離能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合態常見化合價是_________價,其基態原子電子排布式為_________。
(2)Ca3(PO4)3F中非金屬元素電負性由大到小的順序為_________。
(3)PO43-的中心原子的雜化方式為_________,該離子的空間構型為_________,鍵角為________,其等電子體有_________ (請寫出兩種)。
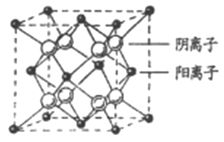
(4)CaF2晶胞結構如圖所示,則CaF2晶體中與Ca2+最近且等距離的Ca2+數目為_________;已知Ca2+和F半徑分別為a cm、b cm,阿伏加德羅常數為NA,M為摩爾質量,則晶體密度為________g·cm3(不必化簡)。
(5)已知MgO與CaO的晶體結構相似,其摩氏硬度的大小關系為_________,原因為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置(氣密性良好),若先將甲中液體滴入丙中,觀察到氣球明顯鼓起,一段時間后恢復原狀;再將乙中液體滴入丁中,氣球又明顯鼓起。下列組合正確的是( )

選項 | 滴管甲 | 燒杯丙 | 滴管乙 | 燒杯丁 |
A | 雙氧水 | 二氧化錳 | 水 | 氫氧化鈣 |
B | 稀硫酸 | 鎂 | 鹽酸 | 碳酸鈣 |
C | 水 | 氫氧化鈉 | 水 | 硝酸銨 |
D | 水 | 氧化鈣 | 鹽酸 | 鎂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有以下物質:①熔化的NaOH ②稀H2SO4溶液 ③KNO3 固體 ④汞(金屬)⑤酒精(C2H5OH)溶液 ⑥干冰,請回答下列問題(用序號填空):
①屬于電解質的是______________________;
②屬于非電解質的是___________________。
(2)有四種物質是:①標況下6.72L CH4;②3.01×1023個HCl;③13.6g H2S;④0.2mol NH3,其中含有原子數最多的是_________,質量最大的是________。(用序號填空)
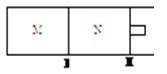
(3)如圖所示,隔板I、Ⅱ均可自由移動,保持溫度相同,若M容器中充入O2,N容器中充入SO2,若兩容器中所含氣體質量相等,則M容器和N容器的體積比為___________;若M容器中充入CO2,N容器中充入CO和H2兩種混合氣體,若隔板不再移動時兩容器體積比為1:1, 則M,N容器中原子總數比為___________。
(4)標況下,體積_____L的CO氣體含電子數與1.7克氫氧根離子OH- 含的電子數相同。
(5)9.5 g MCl2中含有Cl-的物質的量為0.2mol,則該氯化物的摩爾質量為________ g/mol,其中含M2+ 的質量為______g.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D 原子序數依次增加,X、Y、Z、W是由這四種元素中的兩種元素組成的常見化合物,X為有刺激性氣味的氣體,Y為淡黃色固體,甲是由C元素形成的氣體單質,乙為紅棕色氣體,上述物質之間的轉化關系如下圖所示(部分反應物或生成物省略)。下列說法正確的是

A. 原子半徑大小順序:D>C>B>A B. 最簡單氣態氫化物的穩定性:B>C
C. 圖示轉化關系涉及的反應均為氧化還原反應 D. 元素C、D形成的化合物中一定只含離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】aL體積比為1∶3的A、B兩種鏈烴的混合氣體,可與0.5aL(狀態相同)氫氣發生加成反應,則A、B兩種鏈烴的通式可能是( )
A. CnH2n-2和CnH2n+2B. C nH2n和CnH2n+2
C. CnH2n和CnH2nD. CnH2n和CnH2n-2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值。下列有關說法正確的是

A. 1L0.1mol·L-1 NaHSO3溶液中含S原子的粒子個數為0.1NA
B. 標準狀況下,6.72LNO2通入足量水中充分反應,轉移電子數為0.6NA
C. 28gN4(如圖所示)含N一N鍵數目為2NA
D. 1L0.5mol·L-1pH=7的CH3 COONH4溶液中NH4+數目為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當溫度高于 500 K 時,科學家成功利用二氧化碳和氫氣合成了乙醇,這在節能減排、降低碳排放方面具有重大意義。
(1)該反應的化學方程式為________________;其平衡常數表達式為K=________。
(2)在恒容密閉容器中,判斷上述反應達到平衡狀態的依據是________。
a.體系壓強不再改變 b.H2的濃度不再改變 c.氣體的密度不隨時間改變 d.單位時間內消耗 H2和 CO2的物質的量之比為 3∶1
(3)已知:1 g 氫氣完全燃燒生成液態水,放出 143 kJ 熱量;23 g 乙醇完全燃燒生成液態水和二氧化碳,放出 650 kJ 熱量,則氫氣和乙醇的燃燒熱的比值為________。(要求計算出數值)
(4)在一定壓強下,測得由 CO2制取 CH3CH2OH 的實驗數據中,起始投料比、溫度與 CO2的轉化率的關系如圖所示,根據圖中數據

①降低溫度,平衡向________方向移動。
②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 時,H2的轉化率為________。
③在 500 K、起始投料比n(H2)/n(CO2)=2 時, 達到平衡后 H2的濃度為a mol·L-1,則達到平衡時 CH3CH2OH 的濃度為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com