
【題目】氮氧化物(主要為NO和NO2)是大氣污染物,如何有效地消除氮氧化物的污染是目前科學家們研究的熱點問題。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一種可行的方法。
①尿素在高溫條件下與NO2反應轉化成無毒氣體,該反應的化學方程式為___。用尿素溶液也可吸收氮氧化物,研究表明,當混合氣體中![]() =1時,總氮還原率最高,隨著,
=1時,總氮還原率最高,隨著,![]() 比值增大,總氮還原率降低的主要原因是___。
比值增大,總氮還原率降低的主要原因是___。
②在一個體積為1L的恒容密閉容器中充入1molCO2和1molNH3,在恒定溫度下使其發生反應2NH3(g)+CO2(g)![]() NH2CONH2(s)+H2O(g) △H<0并達到平衡,混合氣體中氨氣的體積分數隨時間的變化如圖所示。
NH2CONH2(s)+H2O(g) △H<0并達到平衡,混合氣體中氨氣的體積分數隨時間的變化如圖所示。
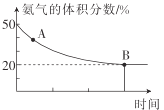
則A點時v正(CO2)___(填“>”“<”或“=”)B點時v正(CO2),原因是___。B點時,NH3的轉化率為___。
③下列有關反應2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的說法正確的是___。
CO(NH2)2(s)+H2O(g)的說法正確的是___。
A.分離出少量的尿素,NH3的轉化率將增大
B.反應達到平衡時,降低反應體系的溫度,CO2的濃度減小
C.NH3的轉化率始終等于CO2的轉化率
D.加入有效的催化劑能夠提高尿素的產率
(2)已知O3氧化氮氧化物的主要反應的熱化學方程式如下:
2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
則反應4NO2(g)+O2(g)=2N2O5(g)△H=___(用含a、b、c的代數式表示)kJ·mol-1。
(3)氮氧化物也可用堿液吸收。若NO和NO2的混合氣體被NaOH溶液完全吸收,只生成一種鹽,則該鹽的化學式為___;已知常溫下Ka(HNO2)=5×10-4,則反應HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常數K=___。
NaNO2(aq)+H2O(l)的平衡常數K=___。
【答案】4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O NO不溶于水,難與尿素反應 > 由A點到B點,溫度不變,氨氣的體積分數減小,正反應速率減小 75% B
7N2+4CO2+8H2O NO不溶于水,難與尿素反應 > 由A點到B點,溫度不變,氨氣的體積分數減小,正反應速率減小 75% B ![]() NaNO2 5×1010
NaNO2 5×1010
【解析】
(1)①尿素[CO(NH2)2]在高溫條件下與與NO2反應轉化成無毒氣體,即生成氮氣、二氧化碳和水,根據NO不溶于水、和水不反應性質解答;
②利用三段式,求解NH3的轉化率;
③根據化學平衡移動原理解答;
(2)利用蓋斯定律求解△H;
(3)根據氧化還原反應規律推測生成物;化學平衡常數k定義:化學平衡常數等于生成物濃度冪積與反應物濃度冪積之比,結合Kw的關系式解答。NO和NO2混合氣體被NaOH溶液完全吸收,只生成一種鹽,該反應中只有N元素化合價發生變化,且NO中N元素化合價為+2、NO2中N元素化合價為+4,則生成的鹽中N元素化合價為+3價,即亞硝酸鹽。
(1)①尿素[CO(NH2)2]在高溫條件下與NO反應轉化成三種無毒氣體,可生成N2、CO2和水,反應的方程式為4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O;由于NO不溶于水,和水不反應,所以氮氧化物氣體中NO的體積分數越大,總氮還原率降低;
7N2+4CO2+8H2O;由于NO不溶于水,和水不反應,所以氮氧化物氣體中NO的體積分數越大,總氮還原率降低;
②恒溫條件下,A點氨氣體積分數大于B的氨氣體積分數,說明A點未達到平衡,反應正向進行,B點達到平衡狀態,則A到B的反應過程中,氨氣的體積分數減小,正反應速率逐漸減小,有A點v正(CO2)>B點時v正(CO2);
設達到平衡狀態時反應了2xmolNH3,有
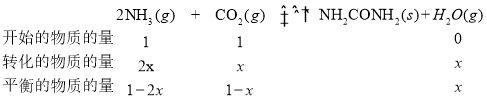
NH3的體積分數為20%,則![]() ,求得x=
,求得x=![]() mol,則NH3的轉化率為
mol,則NH3的轉化率為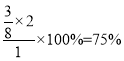 ;
;
③有關反應2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的說法;
CO(NH2)2(s)+H2O(g)的說法;
A.尿素是固體,濃度是個定值,分離出尿素,濃度不改變,化學反應速率不變,平衡不移動,A錯誤;
B.該反應是放熱反應,降低溫度,平衡正向移動,CO2的濃度減小,B正確;
C.根據上問的分析,設達到平衡狀態時反應了2xmolNH3,NH3的轉化率等于![]() ,CO2的轉化率等于
,CO2的轉化率等于![]() ,轉化率不相等,C錯誤;
,轉化率不相等,C錯誤;
D.催化劑能夠對加快化學反應速率,但不能使平衡發生移動,不能提高尿素的產率,D錯誤。
答案選B;
(2)①2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
②NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
③6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
根據蓋斯定律![]() (①+2×③-2×②)得反應4NO2(g)+O2(g)=2N2O5(g),可知△H=
(①+2×③-2×②)得反應4NO2(g)+O2(g)=2N2O5(g),可知△H=![]() (△H1+2
(△H1+2![]() (a+2c-2b);
(a+2c-2b);
(3)NO和NO2混合氣體被NaOH溶液完全吸收,只生成一種鹽,反應中只有N元素化合價發生變化,且這兩種氧化物得失電子相等,NO中N元素化合價為+2、NO2中N元素化合價為+4,則生成的鹽中N元素化合價為+3價,為亞硝酸鹽,化學式為NaNO2。反應HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常數
NaNO2(aq)+H2O(l)的平衡常數![]() (由于Na+實際上沒有參與反應過程,因此沒有出現在表達式中。),上下同時乘以c(H+),有
(由于Na+實際上沒有參與反應過程,因此沒有出現在表達式中。),上下同時乘以c(H+),有![]() ,帶入數據可得
,帶入數據可得![]() 。
。


科目:高中化學 來源: 題型:
【題目】現有容積均為2 L的甲、乙恒容密閉容器,向甲中充入1.5 mol CO2和3 mol H2,乙中充入2 mol CO2、3 mol H2,一定條件下僅發生反應:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),實驗測得反應體系中CO2的平衡轉化率與溫度的關系曲線如圖所示。下列說法正確的是
CH3OH(g)+H2O(g),實驗測得反應體系中CO2的平衡轉化率與溫度的關系曲線如圖所示。下列說法正確的是

A.該反應的ΔH>0
B.曲線Ⅱ表示甲容器中CO2的平衡轉化率與溫度的關系
C.500 K時,該反應的化學平衡常數為200
D.700 K時,若在上述密閉容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,則達到平衡時,H2的體積分數大于![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等許多金屬能形成配合物。
(1)NH3 是一種很好的配體,氨氣分子是_____(填“極性”或“非極性”)分子,NH3 的沸 點_____(填“高于”“等于”或“低于”)AsH3。
(2)科學家通過 X 射線測得膽礬的結構示意圖可簡單表示如下:

圖中虛線表示的作用力為_________________________。
(3)膽礬溶液與氨水在一定條件下可以生成 Cu(NH3)4SO4H2O 晶體。在 Cu(NH3)4SO4·H2O 晶體中,含 有的原子團或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+為平面正方形結構,則 VSEPR 模型為四面體結構的原子團或分子是_____________,其中心原子的雜化軌道類型是________________ 。
(4)金屬鎳粉在 CO 氣流中輕微加熱,生成無色揮發性液態 Ni(CO)4,呈正四面體構型。Ni(CO)4 易溶于_____________________ (填編號)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸鎳溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.鉛蓄電池放電時,負極質量減輕,正極增重
B.升高CH3COONa溶液的溫度,其水的離子積常數和pH均增大
C.CH3CH=CHCH3分子中的四個碳原子都在一條直線上
D.常溫下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,則S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵元素是最重要的金屬元素之一,其不僅是各種鋼材的主要成分,很多含鐵化合物也具有重要意義。
(1)按照電子排布,可把元素周期表中的元素劃分成五個區,鐵元素屬于_________區。
(2)Mn2+在水溶液中難被氧化,而Fe2+則易被氧化為Fe3+ ,請從離子的價電子式角度解釋Mn2+與Fe2+還原能力的差別:_________。Mn2+的半徑_________ Fe3+的半徑(填“>”、“<”或“=”)。
(3)金屬鐵晶體中鐵原子采用體心立方堆積,該鐵晶體的空間利用率為_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成紅色的[Fe(SCN)(H2O)5]2+。N、H、O三種元素的電負性由大到小的順序為_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位數為_________,H2O中氧原子的雜化方式為_________。
(5)二茂鐵是一種含鐵的有機化合物,其化學式為Fe(C5H5)2,可看作是Fe2+離子與兩個正五邊形的環戊二烯負離子(C5H![]() )配體形成的夾心型分子(如下圖a所示)。已知大π鍵可用符號Π
)配體形成的夾心型分子(如下圖a所示)。已知大π鍵可用符號Π![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為Π),則C5H
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為Π),則C5H![]() 的大π鍵表示為________。二茂鐵是黃色針狀晶體,熔點173 ℃(在100 ℃時開始升華),沸點249 ℃,在水中難溶,但可溶于很多有機溶劑。下列相互作用中,二茂鐵晶體中不存在的是________(填標號)。
的大π鍵表示為________。二茂鐵是黃色針狀晶體,熔點173 ℃(在100 ℃時開始升華),沸點249 ℃,在水中難溶,但可溶于很多有機溶劑。下列相互作用中,二茂鐵晶體中不存在的是________(填標號)。
A 離子鍵 B 配位鍵 C σ 鍵 D 范德華力
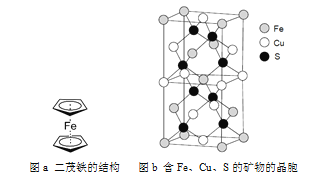
(6)一種含有Fe、Cu、S三種元素的礦物的晶胞(如上圖b所示),屬于四方晶系(晶胞底面為正方形),晶胞中S原子位于內部,Fe原子位于體心和晶胞表面,Cu原子位于晶胞表面。此礦物的化學式為_________。若晶胞的底面邊長為A pm,高為C pm,阿伏伽德羅常數為NA,則該晶體的密度為__________ g/cm3(寫出表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.100 mL 1 mol·L-1 NaClO溶液中ClO-的數目為0.1NA
B.46 g 75%的C2H5OH溶液中所含O原子數目為0.75NA
C.7.6 g過氧乙酸(CH3COOOH)所含過氧鍵數目為0.1NA
D.標準狀況下,22.4 L 氯氣與水充分反應轉移電子數目NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《Journal of Energy Chemistry》報導我國科學家設計二氧化碳熔鹽捕獲及電化學轉化裝置,其示意圖如下:

下列說法不正確的是
A.c為電源的負極
B.a極的電極反應式為:2C2O52- -4e- =4CO2 ↑+O2↑
C.①②中,捕獲CO2時碳元素的化合價均未發生變化
D.轉移l mol電子可捕獲CO2 11.2 L(標況下)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數,下列敘述正確的是
A.1mol H2O2完全分解產生O2時,轉移的電子數為2 NA
B.0. lmol 環氧乙烷(![]() ) 中含有的共價鍵數為0. 3 NA
) 中含有的共價鍵數為0. 3 NA
C.常溫下,1L pH= l 的草酸 ( H2C2O4 ) 溶液中H+ 的數目為0. 1NA
D.1mol淀粉水解后產生的葡萄糖分子數目為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com