
從含銀、銅、金和鉑的金屬廢料中提取金、銀、鉑的一種工藝如下:
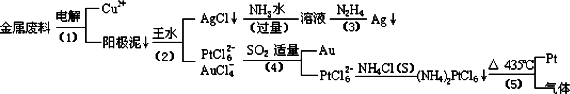
根據以上工藝回答下列問題:
(1)電解時,以金屬廢料為陽極,純銅為陰極,CuSO4溶液為電解液,寫出電解反應的陽極方程式:________
(2)寫出步驟(4)的離子反應方程式:________;
(3)金和濃硝酸反應的化學方程式為:Au+6HNO3(濃)=Au(NO3)3+3NO2↑+3H2O但該反應的平衡常數很小,所以金和濃硝酸幾乎不反應,但金卻可以溶于王水,試簡要解釋之:________.
(4)我們知道,稀鹽酸與銅不反應.在稀鹽酸中加入H2O2等氧化劑后,則可使銅順利溶解.某同學未加入氧化劑,而是設計了一個實驗裝置,也能使銅溶于稀鹽酸.請在方格中畫出該裝置:
(5)分別將等質量的銅片與分別等體積、過量的濃硝酸、稀硝酸反應,所得到的溶液前者呈綠色,后者呈蘭色,甲同學提出可能是Cu2+濃度不同引起的,乙同學提出溶液呈“綠色”是溶液中Cu2+與NO2共存的結果,請你設計實驗探究甲乙兩同學的說法誰更正確(簡述實驗方案和實驗現象及由此得出的結論:________________
 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案 雙基同步導航訓練系列答案
雙基同步導航訓練系列答案 黃岡小狀元同步計算天天練系列答案
黃岡小狀元同步計算天天練系列答案科目:高中化學 來源: 題型:

 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
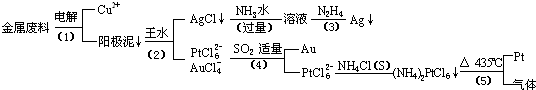
從含銀、銅、金和鉑的金屬廢料中提取金、銀、鉑的一種工藝如下:
根據以上工藝回答下列問題:
電解時,以金屬廢料為陽極,純銅為陰極,CuSO4溶液為電解液,寫出電解方程式:
陽極:
陰極: ;
(2)AgCl溶于氨水后所得的溶液含有的一種陽離子,在堿性條件下,也可用葡萄糖將其還原為銀,寫出該反應的離子方程式:
;
(3)寫出步驟(4)的離子反應方程式:
;
(4)金和濃硝酸反應的化學方程式為:
Au + 6HNO3(濃)= Au(NO3)3 + 3NO2↑+ 3H2O
但該反應的平衡常數很小,所以金和濃硝酸幾乎不反應,但金卻可以溶于王水,試簡要解釋之:
。
查看答案和解析>>
科目:高中化學 來源: 題型:
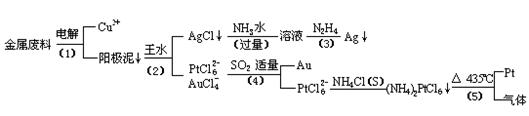
從含銀、銅、金和鉑的金屬廢料中提取金、銀、鉑的一種工藝如下:
根據以上工藝回答下列問題:
(1) 電解時,以金屬廢料為陽極,純銅為陰極,CuSO4溶液為電解液,寫出電解方程式:
陽極:
陰極: ;
(2)AgCl溶于氨水后所得的溶液含有的一種陽離子,在堿性條件下,也可用葡萄糖將其還原為銀,寫出該反應的離子方程式:
;
(3)寫出步驟(4)的離子反應方程式:
;
(4)金和濃硝酸反應的化學方程式為:
Au + 6HNO3(濃)= Au(NO3)3 +3NO2↑+ 3H2O
但該反應的平衡常數很小,所以金和濃硝酸幾乎不反應,但金卻可以溶于王水,試簡要解釋之:
。
查看答案和解析>>
科目:高中化學 來源:2010-2011學年江西省南昌市高三12月月考化學試卷 題型:填空題
從含銀、銅、金和鉑的金屬廢料中提取金、銀、鉑的一種工藝如下:
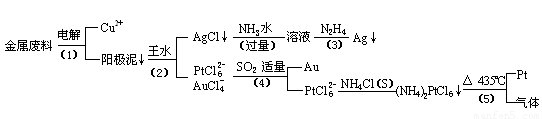
根據以上工藝回答下列問題:
(1) 電解時,以金屬廢料為陽極,純銅為陰極,CuSO4溶液為電解液,寫出電解方程式:
陽極:
陰極: ;
(2)AgCl溶于氨水后所得的溶液含有的一種陽離子,在堿性條件下,也可用葡萄糖將其還原為銀,寫出該反應的離子方程式:
;
(3)寫出步驟(4)的離子反應方程式:
;
(4)金和濃硝酸反應的化學方程式為:
Au + 6HNO3(濃)= Au(NO3)3 + 3NO2↑+ 3H2O
但該反應的平衡常數很小,所以金和濃硝酸幾乎不反應,但金卻可以溶于王水,試簡要解釋之:
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com