
 (1)若向Mg(OH)2濁液中滴入足量的FeCl3溶液,振蕩后,白色沉淀會全部轉化為紅褐色沉淀,試從平衡的角度解釋沉淀轉化的原因:氫氧化鎂濁液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以當加入Fe3+后,會和OH-反應生成更難溶的氫氧化鐵沉淀,使得上述平衡正向移動,最有氫氧化鎂全部轉化為紅褐色的氫氧化鐵沉淀
(1)若向Mg(OH)2濁液中滴入足量的FeCl3溶液,振蕩后,白色沉淀會全部轉化為紅褐色沉淀,試從平衡的角度解釋沉淀轉化的原因:氫氧化鎂濁液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以當加入Fe3+后,會和OH-反應生成更難溶的氫氧化鐵沉淀,使得上述平衡正向移動,最有氫氧化鎂全部轉化為紅褐色的氫氧化鐵沉淀分析 (1)根據沉淀溶解平衡移動的影響因素知識來回答判斷;
(2)根據氫氧化鐵的溶度積及pH=3計算出溶液中鐵離子濃度;
(3)電離平衡常數指弱電解質在一定條件下電離達到平衡時,溶液中電離所生成的各種離子濃度系數次冪的乘積,與溶液中未電離分子的濃度系數次冪的乘積的比值,則H2CO3?HCO3-+H+的平衡常數K=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$;
(4)①根據電極反應及電子守恒來計算;
②根據A中的電極反應及與C中轉移的電子守恒來計算.
解答 解:(1,KSP[Fe(OH)3]<KSP[Mg(OH)2],氫氧化鎂濁液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,當加入Fe3+后,會和OH-反應生成更難溶的氫氧化鐵沉淀,使得上述平衡正向移動,機會生成紅褐色沉淀物質,
故答案為:氫氧化鎂濁液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以當加入Fe3+后,會和OH-反應生成更難溶的氫氧化鐵沉淀,使得上述平衡正向移動,最有氫氧化鎂全部轉化為紅褐色的氫氧化鐵沉淀;
(2)氫氧化鐵的溶度積Ksp[Fe( OH)3]=4.0×10-38,pH=3的溶液中,氫氧根離子的濃度為1×10-11mol/L,c(Fe3+)=$\frac{4×1{0}^{-38}}{(1×1{0}^{-11})^{3}}$mol/L=4.0×10-5mol/L,
故答案為:4.0×10-5;
(3)飽和CO2水溶液的pH=5.6,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5 mol•L-1,
則H2CO3?HCO3-+H+的平衡常數,K=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{2.5×1{0}^{-6}×2.5×1{0}^{-6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,
故答案為:4.2×10-7 mol•L-1;
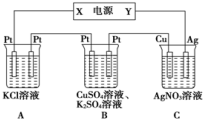
(4)①C中陰極反應為Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,則轉移的電子為0.02mol,
B中陽極反應為4OH--4e-═2H2O+O2↑,則轉移0.02mol電子生成氧氣為0.005mol,其體積為0.005mol×22.4L/mol=0.112L=112mL,
則在陰極也生成112mL氣體,由2H++2e-═H2↑,則氫氣的物質的量為0.005mol,該反應轉移的電子為0.01mol,
則Cu2++2e-═Cu中轉移0.01mol電子,所以Cu2+的物質的量為0.005mol,通電前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案為:0.025 mol•L-1;
②由A中發生2KCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,由電子守恒可知,轉移0.02mol電子時生成0.02molKOH,忽略溶液體積的變化,則c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,故答案為:0.1mol•L-1.
點評 本題考查了沉淀的溶解平衡以及溶度積計算、電離平衡常數的計算以及電解原理,明確Cu電極的質量增加是解答本題的突破口,并明確發生的電極反應及電子守恒即可解答,注意計算時電子守恒的應用,題目難度中等.


科目:高中化學 來源: 題型:實驗題
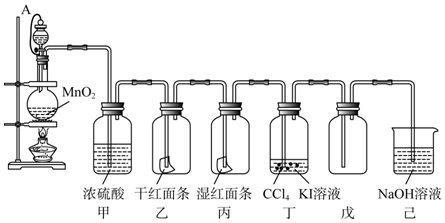
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用稀硫酸溶解四氧化三鐵:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸鈉溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28 g氮氣含有的原子數為NA | |
| B. | 標準狀況下,22.4 L水中含有的水分子數為NA | |
| C. | 1 molOH-含有的電子數為10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+個數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
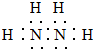 ,HCN中C的化合價為-2.
,HCN中C的化合價為-2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯的結構簡式為:CH2=CH2 | |
| B. | 原子核內有10個中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的結構式為: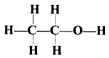 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com